Уравнение Ван-дер-Ваальса – это уравнение состояния реального газа. Оно не является единственным уравнением, характеризующим состояние газа. Таких уравнений предложено более семидесяти. Уравнение Ван-дер-Ваальса является наиболее удачным из всех этих уравнений. Оно, в общем, правильно передает зависимость давления от объема для реального газа. В него входят всего три константы, одна из которых является универсальной газовой постоянной R. В дальнейшем (для упрощения вычислений) будем рассматривать только один моль газа. Для одного моля идеального газа уравнение Менделеева – Клапейрона, т.е. уравнение состояния идеального газа, записывалось так:
 ,(16.1)
,(16.1)
где P – давление газа; V 0– объем одного моля газа; Т – абсолютная температура газа. В это уравнение надо внести поправки, учитывающие свойства реального газа.
Первая поправка – это учет собственного объема молекул газа. Хотя собственный объем одной молекулы может показаться ничтожно малой величиной, учитывая огромное число молекул, находящихся в данном объеме газа, нельзя пренебрегать собственным объемом всех молекул. Собственный объем молекул сказывается в том, что молекулы движутся в данном объеме менее свободно, чем, если бы они были точечными. Если рассматривается объем V 0одного моля газа, то свободное пространство, в котором движутся молекулы, будет меньше чем V 0.С учетом собственного объема молекулы уравнение (16.1) запишется так:
 , (16.2)
, (16.2)
где b – поправка на собственный объем молекул, рассчитанная на 1 моль газа. Теоретические расчеты показывают, что 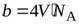 , где V¢ – собственный объем одной молекулы газа, N A– число Авогадро, т.е. число молекул в одном моле. Поправку «b» определены экспериментально.
, где V¢ – собственный объем одной молекулы газа, N A– число Авогадро, т.е. число молекул в одном моле. Поправку «b» определены экспериментально.
Вторая поправка – это учет сил взаимодействия между молекулами реального газа. Молекулы реального газа, находясь на некотором расстоянии друг от друга, взаимно притягиваются. Эти силы притяжения лишь при очень малых расстояниях между молекулами (в момент столкновения) сменяются силами отталкивания. В результате сил притяжения между молекулами газ как бы «сжимается» так, как если бы газ находился под бόльшим давлением P ¢, чем то внешнее давление P, которое на него оказывают стенки сосуда. С учетом сил притяжения в выражении (16.1) давление P надо заменить на P ¢ = P + Pi. Величина 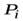 называется внутренним давлением газа. Теоретические расчеты показывают, что
называется внутренним давлением газа. Теоретические расчеты показывают, что 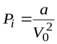 , где V 0– объем одного моля газа, а – константа, которая также определена экспериментально. С учетом обеих поправок, уравнение состояния реального газа запишется так:
, где V 0– объем одного моля газа, а – константа, которая также определена экспериментально. С учетом обеих поправок, уравнение состояния реального газа запишется так:
 .(16.3)
.(16.3)
Это уравнение Ван-дер-Ваальса для одного моля реального газа. R – универсальная газовая постоянная, «а» и «b» – константы, различные для разных газов, они определены экспериментально.
16.2. Изотермы реального газа. Критическое состояние
Уравнение состояния реального газа – это уравнение Ван-дер-Ваальса. Построим график зависимости давления газа Ван-дер-Ваальса от его объёма при постоянной температуре (рис. 16.1), выразив давление P через объём V из уравнения  :
:  .Кривые, построенные согласно этому уравнению, имеют вид, показанный на рисунке, и называются изотермами Ван-дер-Ваальса, т.к. каждая кривая соответствует определенной температуре Т. При высоких температурах изотермы Ван-дер-Ваальса напоминают изотермы идеального газа; при более низких температурах изотермы Ван-дер-Ваальса имеют в определенной области давлений и объемов минимум и максимум.
.Кривые, построенные согласно этому уравнению, имеют вид, показанный на рисунке, и называются изотермами Ван-дер-Ваальса, т.к. каждая кривая соответствует определенной температуре Т. При высоких температурах изотермы Ван-дер-Ваальса напоминают изотермы идеального газа; при более низких температурах изотермы Ван-дер-Ваальса имеют в определенной области давлений и объемов минимум и максимум.
Уравнение Ван-дер-Ваальса было получено теоретически, и с точки зрения математики построение кривых согласно уравнению (16.3) сомнений не вызывает. Но для того, чтобы выяснить смысл этой, на первый взгляд странной зависимости, надо обратиться к опыту.
Если взять какой-нибудь реальный газ, поместить его под поршень в цилиндр и экспериментально найти зависимость  при различных температурах, то кривые будут иметь вид, показанный нарис. 16.2. При высоких температурах изотермы реального газа, рассчитанные теоретически, совпадают с изотермами, найденными экспериментально. Кроме того, изотермы реального газа при высоких температурах очень близки к изотермам идеального газа, которые подчиняются закону Бойля – Мариотта. При более низких температурах в той области, где теоретические изотермы Ван-дер-Ваальса имеют минимум и максимум, экспериментальные изотермы имеют прямолинейные участки.
при различных температурах, то кривые будут иметь вид, показанный нарис. 16.2. При высоких температурах изотермы реального газа, рассчитанные теоретически, совпадают с изотермами, найденными экспериментально. Кроме того, изотермы реального газа при высоких температурах очень близки к изотермам идеального газа, которые подчиняются закону Бойля – Мариотта. При более низких температурах в той области, где теоретические изотермы Ван-дер-Ваальса имеют минимум и максимум, экспериментальные изотермы имеют прямолинейные участки.
Чертим отдельно одну теоретическую изотерму и при той же самой температуре экспериментальную изотерму. Если эти рисунки наложить друг на друга, то они совместятся друг с другом за исключением участка ВС.
 |  |
Начнем сжимать газ, поддерживая его температуру постоянной, с какой-нибудь точки А. Ветвь изотермы АВ (на обоих рисунках) соответствует сжатию газа при низких давлениях. Свойства газа на участке АВ очень близки к свойствам идеального газа. При достижении некоторого давления Р 0поведение газа резко меняется.
Газ продолжаем сжимать, его объем уменьшается, а давление остается одним и тем же (рис. 16.3), равным Р 0. Участок ВС на экспериментальнойизотерме соответствует процессу сжижения газа, т.е. на участке ВС газ превращается в жидкость (ВС – линия конденсации пара). В этой области вещество существует одновременно в двух фазах: жидкость – одна фаза, и вторая фаза – газ, который в данном случае является насыщенным паром по отношению к жидкости. Давление насыщенного пара зависит только от температуры, но не зависит от объема. Поэтому давление Р 0не меняется до тех пор, пока весь пар при данной температуре, не перейдет в жидкость. Давление P 0называется упругостью насыщенных паров при даннойтемпературе Т. В точке В все вещество еще было в газообразном состоянии, в точке С все вещество находится уже в жидком состоянии.
Ветвь изотермы СД (на обеих изотермах) характеризует процесс сжатия жидкости. Жидкости обладают малой сжимаемостью, поэтому кривая СД круто идет вверх.
Участок ВЕ теоретической изотермы Ван-дер-Ваальса можно получить на опыте. Участок ВЕ характеризует пересыщенный пар, т.е. пар, плотность которого больше плотности насыщенного пара при данной температуре. Состояние пересыщенного пара – малоустойчивое состояние. Пар легко конденсируется, частично переходит в жидкость, а оставшийся пар тогда будет уже насыщенным паром.
Участок СF теоретическойизотермы Ван-дер-Ваальса также можно получить экспериментально. Он характеризует малоустойчивоесостояние растянутой жидкости, т.е. жидкости с меньшей плотностью, чем ей положено иметь при данной температуре. Такая жидкость получается, если её особенно тщательно очистить от всяких примесей.
 Участок FЕ теоретическойизотермы Ван-дер-Ваальса экспериментально получить нельзя.
Участок FЕ теоретическойизотермы Ван-дер-Ваальса экспериментально получить нельзя.
Каждая экспериментальная изотерма соответствует одной какой-либо температуре Т = const. С повышением температуры Т прямолинейные участки соответствующих изотерм становятся все уже и при какой-то температуре Т кточки В и С, ограничивающие прямолинейный участок, сольются в одну точку К. Изотерма, на которой линия конденсации изображается в виде точки, является критической изотермой. Температура, соответствующая критической изотерме – критическая температура T к. Изотерма, соответствующая критическойтемпературе Т к, имеет только точку перегиба К. Касательная к точке К параллельна оси абсцисс. Изотермы при температурах выше Т кне имеют ни максимумов, ни минимумов, ни прямолинейных участков и близки к изотермам идеального газа.
Точка К называется критической точкой. Т к, соответствующие ей P ки V кназываются критическими температурой, давлением и объемом соответственно. Критической температурой Т к называется температура, при которой исчезает различие между жидким и газообразным состоянием вещества. Для разных веществ критическая температура Т кразлична. Состояние вещества при критической температуре называется критическим состоянием вещества. В этом состоянии вещество приобретает особые свойства, например, исчезают силы сцепления между молекулами, вещество не имеет поверхностного натяжения и т.п.
При температурах ниже критической вещество может существовать в зависимости от давления либо в жидком, либо в газообразном состоянии, либо в двухфазном состоянии (жидкость и ее пар одновременно).
При температурах выше критической температуры вещество может существовать только в газообразном состоянии и никаким сжатием не может быть переведено в жидкое состояние. Газ сначала надо охладить до Т < Т к, и только потом сжимать.
Критическому состоянию вещества соответствует единственная точка критической изотермы – точка, в которую превратилась линия конденсации. Эта точка называется критической. Параметры вещества в критической точке называют критическими параметрами. Для их определения необходимо установить положение критической точки на координатной плоскости P, V.
Любая изотерма Ван-дер-Ваальса, в том числе и критическая, описывается уравнением  . Так как критическая точка является точкой перегиба изотермы Ван-дер-Ваальса, в ней равны нулю первая и вторая производные по объёму функции
. Так как критическая точка является точкой перегиба изотермы Ван-дер-Ваальса, в ней равны нулю первая и вторая производные по объёму функции  при T = const:
при T = const:

Решая уравнения совместно, найдем значения критических параметров:
 (16.4)
(16.4)
где а, b – константы из уравнения Ван-дер-Ваальса, описывающего состояние данного реального газа, R – универсальная газовая постоянная. На рисунке областьI(заштрихована) – это область двухфазного состояния вещества, областьII(двойная штриховка) – это область жидкого состояния, областьIII(не заштриховано) – это область газообразного состояния.
 2017-12-14
2017-12-14 2990
2990