 |
| Рис. 2.9. График адиабатного процесса |
Используя график изотермического процесса (рис. 2.8), можно показать, что изменение внутренней энергии газа в любом процессе  . Действительно, во всех процессах a, b и c, начинающихся в точке 0 и заканчивающихся на изотерме, изменение внутренней энергии будет одинаково, т.е.
. Действительно, во всех процессах a, b и c, начинающихся в точке 0 и заканчивающихся на изотерме, изменение внутренней энергии будет одинаково, т.е.  , так как начальное и конечное значение температуры в этих процессах одно и то же.
, так как начальное и конечное значение температуры в этих процессах одно и то же.
Но согласно первому закону термодинамики в изохорном процессе a теплота, подведенная к газу, идет только на увеличение его внутренней энергии, т.к. в этом процессе газ не совершает работу, т.е. 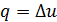 . Как установлено выше, в изохорном процессе
. Как установлено выше, в изохорном процессе 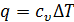 . Отсюда следует, что в любом процессе
. Отсюда следует, что в любом процессе
 .
.
Адиабатный процесс
Адиабатным называется процесс, протекающий при отсутствии теплообмена с окружающей средой (т.е. при q = 0).
1. Уравнение процесса.
Для вывода уравнения процесса запишем уравнение первого закона термодинамики в двух формах:
 и
и 
или в виде  и
и  .
.
Разделив второе уравнение на первое, получим
 или
или  ,
,
где 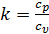 – показатель адиабаты.
– показатель адиабаты.
Проинтегрировав последнее уравнение, получим
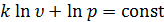 или
или  .
.
Откуда следует выражение для уравнения адиабатного процесса в виде
 . (2.22)
. (2.22)
2. График процесса. Из уравнения процесса (2.22) следует, что  . В р, υ -координатах – это неравнобокая гипербола. Так как k >1, то адиабата протекает круче изотермы (рис. 2.9).
. В р, υ -координатах – это неравнобокая гипербола. Так как k >1, то адиабата протекает круче изотермы (рис. 2.9).
3. Связь между параметрами состояния газа. Для этого запишем уравнение адиабаты для точек 2 и 1 и разделим их друг на друга
 ,
,  .
.
Тогда получим
 . (2.23)
. (2.23)
Из уравнения состояния, записанного для точек 1 и 2 (рис. 2.9), следует, что  . Используя соотношение (2.23), получим
. Используя соотношение (2.23), получим
 . (2.24)
. (2.24)
4. Теплоемкость газа в адиабатном процессе. Так как в этом процессе  , а
, а  , то
, то
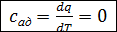 .
.
5. Определение количества теплоты q, подведенной к газу, совершенной им работы l и изменения его внутренней энергии Δ u:
- количество тепла, подведенного к газу  ;
;
- изменение внутренней энергии газа
 ;
;
- для адиабатного процесса по определению q = 0. Тогда из первого закона термодинамики следует, что при q = 0 работа расширения газа
 , (2.25)
, (2.25)
т. е. в адиабатном процессе работа газа совершается за счет убыли его внутренней энергии. Поэтому, как видно из формулы (2.25), адиабатное расширение газа (т.е. при  сопровождается уменьшением его температуры, а сжатие - повышением.
сопровождается уменьшением его температуры, а сжатие - повышением.
Из уравнения Майера  и выражения для показателя адиабаты
и выражения для показателя адиабаты 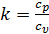 следует, что
следует, что  , a
, a  , тогда
, тогда
 . (2.26)
. (2.26)
Политропные процессы
1. К политропным относятся процессы, подчиняющиеся уравнению
 , (2.27)
, (2.27)
 |
| Рис. 2.10. График политропных процессов |
где  – показатель политропы, который может принимать значения ±∞. Для данного политропного процесса величина
– показатель политропы, который может принимать значения ±∞. Для данного политропного процесса величина  постоянная.
постоянная.
2. График политропных процессов. Политропный процесс является обобщающим по отношению к основным термодинамическим процессам. Действительно:
- если  , то из уравнения политропного процесса получим уравнение изобарного процесса, т.к.
, то из уравнения политропного процесса получим уравнение изобарного процесса, т.к. 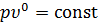 или
или  ;
;
- если 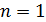 , тогда
, тогда 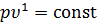 . Из уравнения состояния следует, что
. Из уравнения состояния следует, что 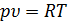 . Следовательно, значению
. Следовательно, значению 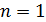 соответствует уравнение изотермического процесса
соответствует уравнение изотермического процесса  ;
;
- если  , то из уравнения политропного процесса получим уравнение адиабатного процесса
, то из уравнения политропного процесса получим уравнение адиабатного процесса  ;
;
- если  , то из уравнения политропного процесса
, то из уравнения политропного процесса  получим
получим  – т.е. уравнение изохорного процесса.
– т.е. уравнение изохорного процесса.
3. Связь между параметрами состояния газа в политропном процессе аналогичны связи в адиабатном процессе, а именно
 ,
,  .
.
4. Определение количества теплоты q, подведенной к газу, совершенной им работы l и изменения его внутренней энергии Δ u: По аналогии с адиабатным процессом:
- количество тепла, подведенного к газу 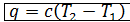 ;
;
- изменение внутренней энергии газа  ;
;
- работа газа в политропном процессе
 ,
,
5. Теплоемкость политропного процесса. Подставляя значения q,  и
и  в уравнение первого закона термодинамики
в уравнение первого закона термодинамики  , получим
, получим

или  .
.
Окончательно для политропного процесса теплоемкость газа равна
 . (2.28)
. (2.28)
Таким образом, теплоемкость политропного процесса зависит от показателя политропы  и рода газа, т.к.
и рода газа, т.к.  и
и  зависят от рода газа.
зависят от рода газа.
Теплоемкость в каждом политропном процессе имеет вполне определенную величину, зависящую от значений  , k и
, k и  . Причем, в зависимости от показателя политропы, теплоемкость может быть положительной или отрицательной, а в отдельных случаях равной нулю (в адиабатном процессе) или бесконечности (в изотермическом процессе). Действительно, в соответствии с (2.28):
. Причем, в зависимости от показателя политропы, теплоемкость может быть положительной или отрицательной, а в отдельных случаях равной нулю (в адиабатном процессе) или бесконечности (в изотермическом процессе). Действительно, в соответствии с (2.28):
- в изобарном процессе  , тогда
, тогда  ;
;
- в изотермическом процессе 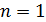 →
→  ;
;
- в адиабатном процессе  →
→  ;
;
- в изохорном процессе  →
→ 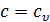 .
.
 2017-10-25
2017-10-25 779
779








