Энтропией называется термодинамическая функция, полный дифференциал которой  ,
,
где  – тепло, подведенное к газу в обратимом процессе. Размерность энтропии Дж/(кг∙К).
– тепло, подведенное к газу в обратимом процессе. Размерность энтропии Дж/(кг∙К).
3.7.1. Свойства энтропии в обратимых процессах
1. Для кругового обратимого процесса из неравенства Клазиуса следует, что  или
или  .
.
2. Изменение энтропии  в любом обратимом процессе перехода вещества из состояния 1 в состояние 2 не зависит от пути этого процесса, а зависит только от параметров вещества в его начальном и конечном состояниях.
в любом обратимом процессе перехода вещества из состояния 1 в состояние 2 не зависит от пути этого процесса, а зависит только от параметров вещества в его начальном и конечном состояниях.
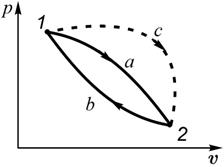
Докажем это, рассмотрев обратимый круговой процесс 1-а-2-b-1 (рис.3.9), в котором некоторое тело (газ) сначала переходит из состояния 1 в
состояние 2 по пути 1-а-2, а потом возвращается в состояние 1 по пути 2-b-1. Согласно неравенству Клаузиуса, в этом случае
 или
или  .
.
Теперь рассмотрим такой же процесс, но с переходом из состояния 1 в состояние 2 по другому пути 1-с-2 (см. рис. 3.9). В этом случае также
 или
или 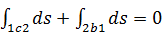 .
.
Сравнивая эти равенства, видим, что
 или
или 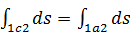 .
.
Таким образом, энтропия является функцией состояния вещества, а её величина однозначно определяется параметрами его состояния в начале и конце процесса.
3. Энтропия термодинамической системы, состоящей из нескольких частей (энтропии которых равны S1, S2,..., Sn), равна сумме энтропий всех её частей:
 .
.
4. Энтропия отдельного тела или системы тел в различных обратимых процессах может как возрастать, так и уменьшаться. Действительно, из определения энтропии следует, что 
 .
.
Так как  , а
, а  может быть как положительным, так и отрицательным, то подводу теплоты соответствует
может быть как положительным, так и отрицательным, то подводу теплоты соответствует  , а отводу -
, а отводу -  .
.
 |  |
| Рис. 3.9 | Рис. 3.10 |
3.7.2. Особенности изменения энтропии в необратимых процессах
Пусть рабочее тело переходит из состояния 1 в состояние 2 в необратимом процессе 1а2, а возвращается в исходное состояние в обратимом процессе 2б1 (рис. 3.10). Тогда цикл 1а2б1 является необратимым и для него справедливо неравенство Клазиуса  или
или  .
.
Но для обратимого процесса 
 .
.
Тогда для необратимого процесса  получим
получим  .
.
Таким образом, в необратимых процессах изменение энтропии всегда больше интегральной суммы приведенных теплот данного процесса.
В дифференциальной форме последнее неравенство для необратимых процессов можно записать в виде 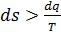 .
.
Это соотношение можно объединить с выражением для обратимых процессов, в которых 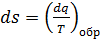 .
.
Тогда в общем случае получим  .
.
Знак  относится к необратимым процессам, а знак равенства – к обратимым процессам.
относится к необратимым процессам, а знак равенства – к обратимым процессам.
Это выражение является аналитической записью второго закона термодинамики.
 2017-10-25
2017-10-25 3615
3615
