Метод ионного обмена был первым промышленным методом, позволившим получить индивидуальные РЗЭ высокой чистоты. Сейчас этот метод используется в промышленных масштабах реже из-за низкой производительности, невозможности организовать полностью непрерывный процесс (большое число промежуточных фракций), длительности. Процесс обратный ионному обмену (сорбции) называют десорбция или элюирование.
Процесс ионного обмена основан на способности некоторых твердых веществ (ионитов, сорбентов) поглощать из растворов электролитов ионы в обмен на ионы того же знака, входящие в состав ионита.
В основном используют в технологии иониты, состоящие из трехмерной полимерной матрицы, к которой закреплена функциональная группу. В свою очередь эта функциональная группа состоит из фиксированного иона, закрепленного на матрице и подвижного противоиона, имеющего заряд противоположный фиксированному иону и способного обмениваться на ионы из раствора. По знаку заряда противоиона иониты бывают катиониты (противоион – катион), аниониты (противоион – анион) и т.д. Кроме этого название ионитов связано с фиксированным ионом, если у катионита фиксированный ион -SO3-, то этот катионит называют сульфокатионит. У анионитов в качестве противоиона выступают анионы минеральных кислот, в основном однозарядные, а фиксированным ионом являются первичные, вторичные, третичные амины и пиридиниевые группы.
Практически ионный обмен проводят либо в статическом, либо в динамическом режиме. В статическом режиме ионит и раствор смешивают в емкости, реакторе. После проведения процесса, ионит отделяют от раствора. В динамическом режиме раствор пропускают через ионообменную колонну, в которой находится ионит. Эти условия обеспечивают непрерывность и производительность процесса.
Равновесие ионообменного процесса можно записать в виде следующего уравнения:
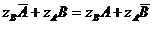 (17),
(17),
где: ион с чертой наверху означает фазу ионита, соответственно без черты фазу раствора. Для описания равновесия ионнообменного процесса используют следующие количественные характеристики:
коэффициент распределения, равный 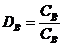 (18);
(18);
коэффициент избирательности, равный 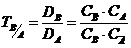 (19).
(19).
Как видно из уравнения 19 коэффициент избирательности показывает насколько данная смола селективна к сорбируемому иону. Если величина ТВ/А >1, то смола избирательна к сорбируемому иону В и наоборот.
Избирательность (селективность) смолы чрезвычайно важна для процесса ионного обмена, поскольку от нее будет зависеть эффективность как ионного обмена, так и процесса разделения ионным обменом двух или нескольких ионов из водного раствора. Избирательность смолы зависит от многих факторов:
- знак и величина заряда сорбируемого иона (чем выше заряд, тем избирательность выше);
- величина энергии гидратации сорбируемого иона (чем сильнее гидратирован ион, тем меньше избирательность);
- природа фиксированного иона;
- состава раствора.
Для различных ионитов по экспериментальным данным составлены ряды селективности, на которые можно ориентироваться при предварительной оценке возможности использования процесса ионного обмена для извлечения или разделения нескольких ионов, близких по свойствам.
Когда речь идет о разделении нескольких компонентов раствора методом сорбции, то используют термин – ионообменная хромотография. Ионообменная хромотография основана на различной скорости передвижения ионов в колонне, заполненной смолой. В свою очередь эта скорость будет зависеть от сродства смолы к данному иону, чем выше сродство, тем меньше скорость.
По способу осуществления ионообменную хроматографию можно подразделить на:
- фронтальную;
- вытеснительную;
- элюэнтную.
Фронтальная хроматография. При использовании фронтальной хроматографии разделение происходит на стадии ионного обмена. Для эффективного разделения сродство ионита к ионам должно различаться значительно. Например, необходимо очистить литиевый раствор от ионов натрия. Для этого раствор, содержащий смесь ионов, Na+ и Li+, пропускают через колонку с сульфокатионитом. Сродство сульфокатионита к иону натрия значительно выше, чем к литию, а, следовательно, скорость движения по колонне у лития будет выше, и он будет выходить из колонны первым, а натрий остается на смоле. Но при этом эффективное разделение будет достигнуто только для иона, который хуже сорбируется. Т.е. в нашем случае мы получим более чистую литиевую фракцию.
Вытеснительная хроматография. При вытеснительной и элюэнтной хроматографии разделение ионов происходит на стадии десорбции. На стадии сорбции через смолу, заряженную ионом А, пропускают раствор, содержащий смесь ионов (В и С), таким образом, чтобы они сорбировались в верхней части колонны. Поскольку свойства элементов близки, разделения на стадии сорбции не происходит.
Процесс десорбции проводят раствором, содержащим ион D. По величине сродства ионита к ионам их можно расположить следующим образом:
D > C > B > A
Поэтому в процессе десорбции ион D будет вытеснять все остальные ионы со смолы, что вызовет движение полосы ионов В и С вниз по колонне. Кроме вытеснения ионов из фазы ионита из-за различия в сродстве смолы к этим ионам внутри полосы будет происходить перераспределение ионов. Выходящий из колонны раствор вначале будет содержать ион А, затем В и С. Выходная кривая десорбции (зависимость концентрации ионов в выходящем растворе от объема пропущенного раствора) для вытеснительной хроматографии, представлена на рис. 15.
| С, моль/л | 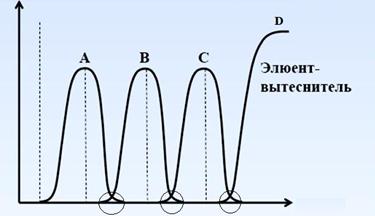 |
| Vэлюата, л или мл |
Рисунок 15. – Выходная кривая процесса десорбции при вытеснительной хромотографии.
Как видно из рисунка для вытеснительной хроматографии характерны острые фронты, и в результате можно получить до 90 ¸ 95% чистых фракций разделяемых элементов.
К недостаткам этого способа следует отнести то, что чрезвычайно затруднен процесс восстановления смолы в исходное состояние, поскольку сродство смолы к ее собственному противоиону значительно ниже, чем к иону D. Этот фактор чрезвычайно удорожает вытеснительную хроматографию.
Элюэнтная хромотография. Для того, чтобы избежать эти недостатки используют элюэнтную хромотографию. Суть ее та же, что и вытеснительной, но на стадии десорбции используют раствор, содержащий исходный противоин ионита – А. Для того, чтобы десорбция протекала концентрация иона А в десорбирующем растворе высокая и объемы пропущенного раствора значительно увеличивается. Выходные кривые десорбции размыты и области перекрывания велики. Таким образом, использование элюэнтной хроматографии не позволит разделить смесь ионов на индивидуальные. Можно разделить только на группы. Тем не менее, этот метод используется в технологии из-за своей доступности и дешевизны.
Для разделения РЗЭ можно использовать метод ионного обмена катионообменными сорбентами, в качестве противоиона – NH4+. Избирательность этих катионитов падает в ряду от лантана к лютецию, поскольку в этом ряду уменьшается радиус иона и увеличивается энергия гидратации. Однако различия в избирательности невелики, поэтому целесообразно использовать либо вытеснительную, либо элюэнтную хромотографию. Экономичнее использовать элюэнтную хроматографию и на первой стадии разделить РЗЭ на группы. Для разделения на индивидуальные РЗЭ можно интенсифицировать процесс введением в десорбирующий раствор добавок. Так, если в элюирующий раствор ввести комплексообразователь, то вымывание РЗЭ из фазы сорбента будет протекать в последовательности соответствующей устойчивости комплексов РЗЭ с этим комплексообразователем, а учитывая, что устойчивость комплексных соединений зависит и от рН элюирующего раствора, то можно достичь высоких величин коэффициентов разделения. Первыми буду вымываться РЗЭ, имеющие высокую устойчивость. В качестве комплексообразователей используют ЭДТА, лимонную кислоту (HOC(CH2COOH)2COOH), нитрилтриуксусную кислоту (N(CH2COOH)3). При использовании в качестве комплексообразователя ЭДТА коэффициенты разделения соседних РЗЭ достигают величины 1,85-3,7. Однако для получения чистых фракций РЗЭ этого, к сожалению, недостаточно. Для повышения эффективности процесса разделения в систему вводят ион замедлитель. После элюирования раствором комплексообразователя, этот раствор, содержащий РЗЭ пропускают через колонку, в которой сорбент насыщен ионом замедлителем (Cu+2). При этом за счет того, что константа устойчивости комплекса меди с ЭДТА выше, чем у РЗЭ, РЗЭ будут переходить в фазу сорбента, а медь в фазу раствора. Таким образом, скорость движение иона РЗЭ по колонке будет уменьшаться, а эффективность разделения и концентрация РЗЭ в фазе смолы расти.
 2017-12-14
2017-12-14 1726
1726








