ВИЗНАЧЕННЯ ЙОНІВ Cr3+ ТА CrO  У РОЗЧИНІ
У РОЗЧИНІ
ТЕОРЕТИЧНА ЧАСТИНА
Хром – твердий блискучий метал, плавиться за температури 1890°С, з густиною 7,19 г/см3. За кімнатної температури хром стійкий до дії води та повітря. Розведені сульфатна і хлоридна кислоти розчиняють хром з виділенням водню. В холодній концентрованій нітратній кислоті хром не розчиняється і після обробки нею пасивується.
В сполуках Хром проявляє різну валентність. Відомі катіони двовалентного Хрому Cr2+, катіони тривалентного Хрому Cr3+, аніони хромат CrO  та дихромат CrO
та дихромат CrO  шестивалентного Хрому.
шестивалентного Хрому.
Солі двовалентного Хрому – блакитного або червоного кольору. На повітрі вони легко окиснюються киснем до солей тривалентного Хрому, що мають зелений або фіолетовий колір. Хром (ІІІ) гідроксид сіро-зеленого кольору, має амфотерні властивості. Хром (VI) оксид або хромовий ангідрид CrO3 – кристали темно-червоного кольору, добре розчинні у воді, при чому утворюється хроматна чи дихроматна кислоти.
Солі хроматної та дихроматної кислот у водному розчині гідролізують. Розчини хроматів мають лужну реакцію, дихроматів – кислу. Гідроліз відбувається за рівняннями:
CrO  + H2O = НCrO
+ H2O = НCrO  + OH-,
+ OH-,
Cr2O 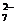 + H2O = 2CrO
+ H2O = 2CrO  + 2H+.
+ 2H+.
Солі тривалентного Хрому можна окиснити до дихроматів в кислому середовищі сильними окисниками типу персульфат-йона чи перманганат-йона. В лужному середовищі для окиснення сполук Хрому (ІІІ) до хроматів достатньо менш сильних окисників, наприклад, хлор, бром, пероксид водню цілком влаштують.
Окиснення тривалентного до шестивалентного Хрому супроводжується зміною забарвлення розчину: зелені або фіолетові розчини тривалентного Хрому набувають жовтого (колір CrO  ) або оранжевого (колір Cr2O
) або оранжевого (колір Cr2O 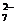 ) забарвлення. Тому реакцією окиснення Хрому (ІІІ) до Хрому (VI) можна відкрити тривалентний хром.
) забарвлення. Тому реакцією окиснення Хрому (ІІІ) до Хрому (VI) можна відкрити тривалентний хром.
 2018-01-08
2018-01-08 1174
1174








