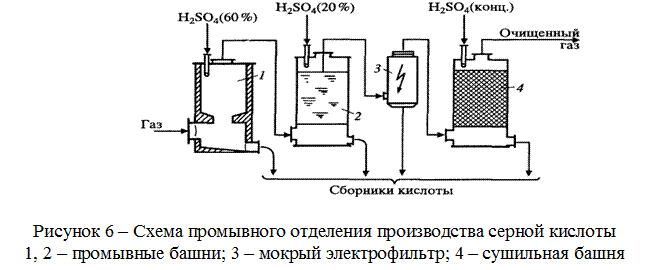
Газы обжига колчедана содержат примеси соединений фтора, селена, теллура, мышьяка и некоторые других элементов. Естественная влага сырья также переходит в газ. При горении образуется некоторое количество SO3, возможно, и оксиды азота. Эти примеси приводят или к коррозии аппаратуры, или к отравлению катализатора окисления SO2 до SO3, а также сказываются на качестве продукта – серной кислоты, поэтому их удаляют в промывном отделении, упрощенная схема которого приведена на рис. 6. В первой промывной башне 1обжиговый газ охлаждается от 200-400оС до 60-70оС, здесь же улавливаются остатки пыли. Во избежание забивания насадки твердым осадком (пылью) используется полая башня. Для частичного поглощения химических примесей газ орошается 50-60%-ной серной кислотой. Разбавленная кислота образует в башне сернокислотный туман с развитой поверхностью, что способствует лучшей абсорбции примесей. Обеспыленный газ отмывается 15-20%-ной кислотой от соединений As, F, Se во второй промывной башне 2, оснащенной насадкой. Частички тумана укрупняются, что облегчает их удаление вместе со сконденсировавшейся влагой в мокром электрофильтре 3. Эта операция необходима, поскольку капли тумана содержат растворенные примеси и вызывают сильную коррозию оборудования. Окончательное удаление остатков влаги осуществляется в сушильной башне 4,орошаемой концентрированной серной кислотой.
Очищенный газ поступает в турбогазодувку, обеспечивающую его транспортировку через систему. Такое расположение нагнетателя рационально: во-первых, в него не попадают корродирующие вещества и, во-вторых, стадии обжига и промывки находятся под небольшим разряжением, что способствует засасыванию воздуха в систему и препятствует выбросам токсичных газов в атмосферу.
5. Процесс окисления SO2 до SO3
Физико-химические основы процесса. Реакция окисления диоксида серы
SО2 + ½О2 = SО3
обратимая, экзотермическая, протекает с уменьшением объема на твердом катализаторе. Константа равновесия КРзависит от температуры и в интервале 400-700оС описывается зависимостью:
lg КР = 4905/Т – 4,6455.
Зависимость равновесной степени превращения SО2 от температуры и давления представлена в таблице 1:
Таблица 1
| Температура, оС | Равновесная степень превращения SО2 (%) при давлении (МПа) | ||||
| 0,1 | 0,5 | 1,0 | 5,0 | 10,0 | |
| 99,2 97,5 93,4 85,5 73,4 | 99,6 98,9 96,9 92,9 85,8 | 99,7 99,2 97,8 94,9 89,5 | 99,9 99,6 99,0 97,7 95,0 | 99,9 99,7 99,3 98,3 96,4 |
Степени превращения, представляющие промышленный интерес (около 99%) достигаются при температурах 400-420оС. Так как давление не сильно влияет на хр,в промышленности процесс проводят при давлении, близком к атмосферному.
Взаимодействие диоксида серы с кислородом, как это следует из стехиометрического уравнения, является реакцией тримолекулярной – должны встретиться три молекулы для совершения акта взаимодействия. Энергия активации весьма велика и составляет более 300 кДж/моль SО3.
Это обстоятельство вынуждает применять катализатор, что ведет к изменению маршрута взаимодействия, снижению энергии активации и, следовательно, увеличению константы скорости реакции.
 2018-01-08
2018-01-08 2472
2472








