Электролиты меднения делятся на два основных типа: кислые и щелочные. К кислым электролитам относятся сернокислые, фторборатные, кремнефторидные и сульфаминовые. К щелочным электролитам относятся цианидные, пирофосфатные и железистосинеродистые электролиты.
Наиболее широкое использование из кислых электролитов в промышленности имеют сернокислые электролиты, которые дешевы, просты по составу, устойчивы при работе и допускают высокие плотности тока. Недостатками кислых электролитов являются их незначительная рассеивающая способность, невозможность непосредственного покрытия в них железа, цинка и их сплавов вследствие контактного выделения меди.
● В кислых электролитах медь находится в виде гидратированных ионов, разряд их на катоде протекает без особых затруднений, и поэтому катодная поляризация незначительна (рис. 3.9, кривая 1). Медь присутствует в растворе в форме ионов двухвалентной меди. Процесс разряда их на катоде выглядит следующим образом:
Сu2+ + 2е → Сu.
Благодаря тому, что стандартный электродный потенциал меди положительнее, водород на катоде не выделяется и выход по току практически близок к 100 %, особенно при проведении электролиза в условиях повышенной температуры и перемешивания электролита.

Рис. 3.9. Поляризационные кривые электроосаждения
меди из различных электролитов:
1 –1,5 моль экв/л СuSО4, 1,5 моль экв/л Н2SО4;
2 – 0,72 моль экв/л СuSО4, 3,85 моль экв/л К4Р2O7(общ);
3 – 0,94 моль/л СuСN, 0,20 моль/л NаСN(общ);
4 – 0,94 моль/л СuСN, 0,45 моль/л NaСN(общ)
В кислом электролите медь (анод) растворяется с образованием в растворе двухвалентных ионов, которые восстанавливаются на катоде. Это видно из значений стандартных электродных потенциалов меди: Сu/Сu+ = -0,51 В; Сu/Сu2+ = +0,337 В; Сu+/Сu2+ = +0,15 В. Однако в растворе в присутствии металлической меди протекает реакция диспропорционирования
 ,
,
в результате которой в растворе появляется небольшое количество ионов одновалентной меди (около 10-3 моль/л). С повышением температуры и понижением кислотности электролита концентрация Сu+ увеличивается, и выпадает губчатая металлическая медь (реакция сдвигается влево), которая ухудшает качество осадка меди на катоде. При высокой кислотности не происходит накопления ионов Сu+, так как одновалентная медь окисляется кислородом воздуха:
 .
.
Наряду с этим с повышением содержания кислоты увеличивается электропроводность раствора и, следовательно, снижается напряжение на ванне. При недостатке кислоты возможен гидролиз соли одновалентной меди с образованием оксида Сu2О, который загрязняет электрохимический осадок:
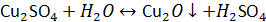 .
.
Осадки меди имеют крупнокристаллическую структуру, но они плотные и компактные.
Распределение тока и металла по поверхности катода сложного профиля неравномерное, что является большим недостатком кислых электролитов.
Кроме того, в кислых электролитах происходит контактное выделение меди на металлах с отрицательными значениями электродных потенциалов (сталь, сплавы цинка и др.). В момент погружения, например, стальных деталей в электролит железо вытесняет медь из раствора по реакции
Fe + CuSО4 → FeSО4 + Cu.
Выделяющаяся на поверхности стали контактная медь непрочно связана с основой, поэтому при последующем электролизе образуется медное покрытие, легко отслаивающееся от основы. Поэтому перед меднением из кислого электролита на детали из стали или цинкового сплава необходимо наносить тонкий слой меди из цианидного электролита или слой никеля.
Сернокислые электролиты для меднения просты, устойчивы и не требуют частой смены состава. Примерный состав сернокислого электролита для меднения, г/л:
СuSО4·5Н2О ………………………………...……………… 150–250
Н2SО4 …………………………………..…………………… 50–70
Электролиз проводят при температуре электролита 25–45 °С и плотности тока 1–6 А/дм2.При плотности тока выше 2 А/дм2 электролит необходимо перемешивать.
Более высокое содержание меди в электролите не рекомендуется, так как при более высокой концентрации медного купороса он может выпадать в виде кристаллов в осадок, выделяясь в первую очередь на анодах, которые перестают растворяться. Серная кислота добавляется для повышения электропроводности электролита и способствует образованию более мелкокристаллических осадков.
В качестве блескообразующих добавок используются различные органические соединения (нафталиндисульфокислота, карбамид, тиокарбамид, сульфирол-8, полиакриламид, производные аминов и т.д.). Процесс осуществляют при 20–50 °С. Катодная плотность тока
2–5 А/дм2, выход по току 95–98 %. Плотность тока можно увеличить до 10–20 А/дм2 при перемешивании электролита (воздушном или механическом).
Наиболее эффективными блескообразующими добавками являются препараты БС-1 и БС-2, а также Лимеда Л-2А, которые вводят специальные электролит вместе с NaС1 в количестве 0,03–0,15 г/л.
Из примесей больше всего в электролите железа, накапливающегося за счет стальных деталей, упавших на дно ванны. Допустимая концентрация железа в электролите составляет не более 20 г/л. Присутствие в электролите никеля и цинка на ход процесса меднения и качество покрытия вредного влияния не оказывает.
Аноды для меднения изготавливают из чистой рафинированной меди (99,9 %), которая содержит не более 0,1 % примесей. Промышленность выпускает холоднокатаные и горячекатаные аноды из меди марок Ml и АМФ в форме пластин толщиной, соответственно, 2–10 и 5–15 мм, шириной до 500 и длиной до 2000 мм.
Неполадки при меднении в сернокислом электролите приведены в табл. 3.10.
При использовании блескообразующих добавок рекомендуют применять фосфорсодержащую медь (0,02÷0,07 % Р) марки АМФ, которая в виде кусков размером 25×25×10 мм загружается в титановые перфорированные корзины с чехлами из полипропиленовой ткани.
Таблица 3.10
Неполадки при меднении в сернокислом электролите
| Неполадки | Причины | Способы устранения |
| Вздутие и отслаивание медного слоя | Плохая подготовка | Улучшить подготовку поверхности |
| Грубая, шероховатая поверхность медного покрытия | Загрязнение электролита механическими примесями | Отшлифовать электролит |
| Темно-красные участки поверхности на выступах и кромках деталей | Высокая плотность тока | Снизить плотность тока или ввести перемешивание |
| Появление блестящих полос на поверхности медного покрытия | Загрязнение электролита органическими соединениями, полировочной пастой | Очистить электролит активированным углем или кипятить с добавкой 1 г/л перманганата калия |
| Черные и коричневые полосы на поверхности медного покрытия | Загрязнение электролита примесями тяжелых металлов (мышьяк, сурьма и др.) | Проработать электролит под током |
| Кристаллизация медного купороса на дне ванны | Чрезмерно высокая концентрация медного купороса в электролите | Отлить часть электролита и разбавить оставшийся электролит водой |
Для ускоренного меднения рекомендуется фторборатный электролит следующих состава, г/л, и режима работы:
Фторборат меди …………………………………………… 220–230
Борная кислота ……………………………………………. 15–16
Борфтористоводородная кислота ………………………… 2–3
РН …………………………………………………………… 1,2–1,7
Температура, °С ……………………………………………. 60–70
Плотность тока, А/дм2 …………………………………….. 25–50
Выход по току, % …………………………………………. 98–100
Основным недостатком этого электролита является невозможность непосредственного меднения стальных деталей. Фтор-боратные электролиты имеют высокую устойчивость раствора, большую растворимость соли и дают возможность проводить процесс при высоких плотностях тока (до 30–35 А/дм2). Широкого применения фторборатные электролиты не получили из-за их высокой стоимости.
При приготовлении фторборатного электролита сначала приготавливают свежеосажденный гидрат окиси меди приливанием разбавленного раствора каустической соды к расчетному количеству растворенного медного купороса, не допуская перегревания осадка и перехода его в черную окись меди. Полученный осадок декантируют, промывают для удаления избытка щелочи и растворяют в ранее приготовленной борфтористоводородной кислоте. Эта реакция идет по следующему уравнению:
Cu(OH)2 + 2HBF4 → Cu(BF4)2 + 2Н2О.
Полученный раствор фторбората меди подкисляют раствором борфтористоводородной кислоты до требуемого значения рН и добавляют борную кислоту для предотвращения гидролиза. Полученный электролит доливают по расчету водой и не прорабатывают.
Аналогичны фторборатным электролитам по своим свойствам кремнефторидные электролиты со следующими составом, г/л, и режимом электролиза:
Кремнефторид меди ……………………………………… 250–300
Кремнефтористоводородная кислота …………………. 10–15
Температура, °С ………………………………………….. 15–60
Катодная плотность тока, А/дм2 ………………………… 8–10
Катодная плотность тока может быть увеличена за счет перемешивания и увеличения температуры.
Борфтороводородные электролиты для меднения состоят из медной соли борфтороводородной кислоты, борфтороводородной и борной кислот. Растворимость борфторида меди значительно выше, чем сульфата, поэтому допустимые плотности тока в этих электролитах более высокие, особенно при перемешивании. Структура осадков меди, получаемых из борфтороводородных электролитов, лучше, чем медных осадков, выделяемых из других кислых электролитов, но рассеивающая способность электролита невысокая.
Примерный состав борфтороводородного электролита для меднения, г/л:
Сu(ВF4)2 …………………………………………………… 225–450
НВF4 ………………………………………………………. 15–30
Н3ВО3 ……………………………………………………… 20–30
Борная кислота необходима для связывания ионов фтора, образующихся в результате частичного гидролиза НВF4:
Н3ВО3 + 3НF ↔ВF3+ 3Н2О.
Для приготовления электролита карбонат меди растворяют в борфтороводородной кислоте, после чегодобавляют борную кислоту. Кислотность электролита должна быть в пределах рН = 0,8÷1,7; температура 25–50 °С, плотность тока до 20–30 × 102 А/м2.
● В комплексных электролитахдля меднения медь находится в растворе в виде комплексных анионов (цианидные, пирофосфатные) или комплексных катионов (сульфатно-аммониевые, этилендиаминовые). Равновесные и катодные потенциалы в комплексных электролитах сдвинуты в область отрицательных значений, причем катодная поляризация наибольшая в цианидных электролитах, особенно при избытке цианида (см. рис. 3.9, кривые 3, 4).
Осадки, выделяемые из цианидных электролитов, очень мелкозернистые, и рассеивающая способность электролита высокая. Поэтому цианидные электролиты незаменимы при покрытии деталей сложнейшего рельефа. Формированию мелкозернистой структуры способствует также уменьшение выхода меди по току с повышением плотности тока (рис. 3.10). В цианидных электролитах основными компонентами являются цианид меди СuСN и цианид натрия NаСN или калия КСN.
При растворении этих компонентов образуются комплексные соединения одновалентной меди, при электролизе которых на катоде осаждается металлическая медь. Комплексные соединения образуются по следующей схеме:   Комплексные анионы [Сu(СN)3]2- диссоциируют, и в зависимости от температуры, соотношения концентрации Сu и СN- и значения рН в растворе устанавливается равновесие между различными формами анионов: Комплексные анионы [Сu(СN)3]2- диссоциируют, и в зависимости от температуры, соотношения концентрации Сu и СN- и значения рН в растворе устанавливается равновесие между различными формами анионов: |  Рис. 3.10. Влияние состава медногоцианидного электролита, температуры и плотности тока на выход металла по току Состав электролита: 1, 2, 3 – 26,2 г/л СuСN, 34,5 г/л NаСN, 60 г/л сегнетовой соли, 30 г/л Nа2СО3; 4, 5, 6 – 41,2 г/л СuСN, 51 г/л NаСN, 60 г/л сегнетовой соли, 30 г/л Nа2СО3 Рис. 3.10. Влияние состава медногоцианидного электролита, температуры и плотности тока на выход металла по току Состав электролита: 1, 2, 3 – 26,2 г/л СuСN, 34,5 г/л NаСN, 60 г/л сегнетовой соли, 30 г/л Nа2СО3; 4, 5, 6 – 41,2 г/л СuСN, 51 г/л NаСN, 60 г/л сегнетовой соли, 30 г/л Nа2СО3 |
 .
.
Константы нестойкости комплексных цианидов очень малы, поэтому концентрация простых ионов меди незначительна.
Необходимо, чтобы, кроме цианида, который связан с медью в комплексном соединении Nа2[Сu(СN)3], электролит содержал простой цианид NаСN для предупреждения гидролиза комплексов меди и обеспечения нормального растворения анодов. При недостатке простого цианида аноды пассивируются, покрываясь пленкой малорастворимых солей. При этом содержание меди в растворе быстро уменьшается, снижается выход по току и ухудшается качество осадка. Когда необходимо процесс вести интенсивно, т. е. при повышенной температуре и высокой плотности тока, концентрацию простого цианида снижают до 5–10 г/л. В этом случае в раствор добавляют депассиваторы анодов, например сегнетову соль КNaС4Н4О6∙4Н2О
(30–60 г/л) или роданид калия КСNS (10–15 г/л). Кроме того, для повышения электропроводности в электролит вводят небольшое количество щелочи.
В результате взаимодействия цианида с диоксидом углерода в цианидных электролитах обычно накапливаются карбонаты и выделяется циановодород:
2NаСN + Н2О + СО2  Na2СО3 + 2НСN.
Na2СО3 + 2НСN.
Циановодород сильно ядовит, поэтому цианидные электролиты очень токсичны, что является большим недостатком, ограничивающим их применение.
Если электролиз ведут при температуре до 40–50 °С, плотность тока может быть повышена до 300 А/м2, при этом скорость осаждения меди значительно увеличивается. Однако следует учитывать, что при этих условиях ускоряется разложение простого цианида с образованием циановодорода, поэтому электролиз следует проводить в условиях сильно действующей вентиляции.
Весьма положительное влияние на качество осадка меди оказывает применение реверсированного тока: осадки становятся более гладкими, ровными, полублестящими. При плотностях тока более
200 А/м2 осадки обрабатывают реверсированным током при отношении времени обработки на катоде к времени обработки на аноде 10:1.
Примерный состав цианидного электролита для меднения, в г/л:
СuСN ……………………………………………………… 50–70
NaОН ……………………………………………………… 10–15
NаСN ……………………………………………………… 5–10
Сегнетова соль …………………………………………… 30–60
Температура, °С …………………………………………. 40–50
Плотность тока, А/м2 ……………………………………. 100–500
Выход по току, % ………………………………………… 70–80
Несмотря на токсичность и недостаточную устойчивость, цианидные электролиты довольно широко применяются в промышленности благодаря следующим преимуществам: мелкокристаллической структуре осадков, беспористости, прекрасному сцеплению со стальной основой, хорошей рассеивающей способности.
В цианидном электролите медь осаждается на катоде из одновалентных ионов, следовательно, при 100 % выходе по току ее должно выделяться вдвое больше, чем в сульфатном электролите при прохождении одного и того же количества электричества. Однако выход по току в этом электролите не 100 %, а наряду с медью на катоде выделяется и водород.
Таким образом, на катоде протекают две реакции:
Сu+ + е → Си; 2Н+ + 2е → Н2.
Главной составной частью медных цианидных электролитов является комплексная медно-натриевая цианистая соль, получаемая растворением цианида меди в цианиде натрия по реакции
CuCN + 2NaCN → Na2[Cu(CN)3].
Из этого уравнения следует, что на 1 г цианистой меди необходимо ввести 0,55 г цианида натрия, причем для обеспечения нормального электролиза в ванне должен быть небольшой избыток цианида натрия (большой избыток приводит к падению выхода по току). В электролите присутствует еще карбонат натрия, который накапливается при взаимодействии цианидов с углекислым газом воздуха. Именно поэтому не следует значительно повышать температуру и производить воздушное перемешивание в цианидном электролите меднения.
В медные цианидные электролиты рекомендуется вводить активаторы (сегнетову соль или роданид калия), обеспечивающие нормальное растворение анодов и позволяющие доводить до минимума концентрацию свободного цианида. В результате взаимодействия цианида натрия с углекислотой воздуха образуется ядовитая синильная кислота:
2NaCN + Н2О + СО2 → Na2CО3 + 2HCN.
Синильная кислота HCN очень неустойчива и разлагается при взаимодействии с водой (гидролиз) с образованием муравьиной кислоты и аммиака:
HCN + 2H2О → HCOOH + NH3.
Однако в присутствии значительного количества гидроксида натрия синильная кислота не образуется:
2NaCN + 2Н2О + 2NaOH + О2 → 2Na2CО3 + 2NH3.
По этой причине следует поддерживать в ванне достаточно высокую концентрацию гидроксида натрия и периодически корректировать содержание цианида натрия. На ваннах во избежание отравления должна быть мощная бортовая вентиляция. Вместо цианида натрия можно использовать цианид калия.
Наиболее простой медный цианидный электролит имеет состав, г/л:
Цианид меди ………………………………………………… 50–90
Цианид натрия ……………………………………………… 10–20
Углекислый натрий …………………………………………. 20–30
Процесс осуществляют на холоде при катодной плотности тока 2–3 А/дм2, выход по току 70–85 %. Аноды должны быть из чистой электролитной меди.
Неполадки при меднении в цианидных электролитах приведены в табл. 3.11.
Во всех цианидных электролитах во избежание пассивирования, особенно при низкой температуре, высокой плотности тока и малом содержании свободного цианида рекомендуется поддерживать отношение площадей анодной поверхности к катодной, равное 2:1.
Пирофосфатные электролиты, а также этилендиаминовые, триполифосфатные, полиэтиленполиаминовые и роданидные разработаны для замены токсичных цианидных электролитов. Из них получили наибольшее применение этилендиаминовые и пирофосфатные электролиты.
Таблица 3.11
Неполадки при нанесении медных покрытий
в цианидных электролитах
| Неполадки | Причины | Способы устранения |
| Медленное осаждение меди. Аноды чистые и блестящие | Высокая плотность тока на катоде | Понизить катодную плотность тока |
| Интенсивное выделение водорода | Низкая концентрация меди | Добавить медь в электролит |
| Темно-красный цвет медного покрытия | Высокая плотность тока | Снизить плотность тока |
| Электролит вблизи анода имеет голубую окраску; на анодах светло-серый или коричневый налет | Пониженная концентрация цианидов или высокая анодная плотность тока | Добавить цианистый натрий; зачистить аноды; уменьшить анодную плотность тока, увеличив число анодов или уменьшив загрузку и силу тока |
Из пирофосфатных электролитов медь осаждается при высокой катодной поляризации (см. рис. 3.9, кривая 2), особенно при большом соотношении концентрации ионов Р2О74- и ионов меди. В этих условиях получаются мелкокристаллические плотные осадки меди, имеющие прочное сцепление с основой и равномерно распределенные на покрываемой поверхности.
В состав пирофосфатных электролитов входит комплексная соль пирофосфата меди Nа6[Сu(Р2О7)2], пирофосфат натрия Nа4Р2О7 и двухзамещенный фосфат натрия Na2НРО4. В щелочном растворе при рН=8 медь находится в основном в виде комплексных анионов [Сu(Р2О7)]6-, которые образуются при диссоциации комплексной соли:
 .
.
При рН < 8 возрастает содержание комплекса Сu(Р2О7)2-. Для повышения устойчивости комплексной соли в растворе поддерживается избыток пирофосфата натрия в количестве 100–200 г/л.
Прочность сцепления медного покрытия со сталью, с цинковыми и алюминиевыми сплавами улучшается.
Вместо цианидных электролитов меднения иногда используются пирофосфатные электролиты, обладающие высокой рассеивающей способностью. При взаимодействии сернокислой меди с пирофосфатом натрия образуется сложная комплексная соль:
2CuSО4 + Na4P2О7 → Cu2P2О7 + 2Na2SО4;
Cu2P2О7 + 3Na4P2О7 → 2Na6[Cu(P2О7)2].
Состав, г/л, и режим работы электролита:
Пирофосфорнокислый натрий (кристаллогидрат) ……… 110
Фосфорнокислый натрий …………………………………. 95
Сернокислый магний ……………………………………… 35
pН …………………………………………………………… 8–9
Катодная плотность тока, А/дм2 …………………………. 0,5–0,6
Температура, °С …………………………………………... 18– 25
Выход по току, % ………………………………………….. 98
При перемешивании и нагреве электролита до 50–60°С можно повысить плотность тока до 1,5–2,0 А/дм2.
Медные аноды в пирофосфатном электролите склонны к пассивированию. Это проявляется в тем большей степени, чем меньше свободного пирофосфата, ниже температура электролита и больше анодная плотность тока. Пирофосфатные электролиты нетоксичны, но применение их ограничено из-за высокой стоимости солей и контактного выделения меди на поверхности стальных деталей.
Удалять медные покрытия с поверхности стальных деталей можно химическим и электрохимическим способами. Самыми распространенными являются следующие способы: 1) в растворе состава, г/л: хромовый ангидрид – 480, серная кислота – 64 при температуре от 20 до 70 °С; скорость растворения меди при этом составляет от 50 мкм/ч до 300 мкм/ч; 2) анодное растворение меди в цианидном или хромовокислом электролитах. При втором способе снятия меди со стали рекомендуются электролиты следующих составов, г/л:
NaCN – 90–95; NaOH – 15; температура – 20–25 °С; напряжение – 6 В; скорость растворения меди – ≈50 мкм/ч.
 2018-01-08
2018-01-08 11141
11141








