Электрохимическое осаждение никеля производится из сульфатно-хлоридных, борфтороводородных и сульфаматных электролитов.
Наиболее распространен сульфатно-хлоридный электролит. При электролизе на катоде происходит разряд ионов никеля и ионов водорода по реакциям
Ni2+ + 2e → Ni; 2Н+ + 2e → Н2.
Таким образом, выход по току при электроосаждении никеля не 100 %, так как часть тока тратится на выделение водорода.
Основным компонентом никелевых электролитов является сернокислый или хлористый никель. Процесс выделения никеля из растворов простых солей сопровождается высокой катодной поляризацией, которая резко снижается с повышением температуры (рис. 3.11).

Рис. 3.11. Поляризационные
Кривые электроосаждения никеля
из электролита, содержащего 150 г/л NiSО4·7Н2О
и 30 г/л Н3ВО3 (pН = 4,0)
Осадки никеля имеют мелкокристаллическую структуру благодаря значительному перенапряжению в процессе электроосаждения.
Рассеивающая способность электролитов для никелирования недостаточна. Это объясняется тем, что в интервале рабочих плотностей тока от 1до 5 А/дм2 катодные потенциалы изменяются мало, а выход никеля по току повышается (рис. 3.12).
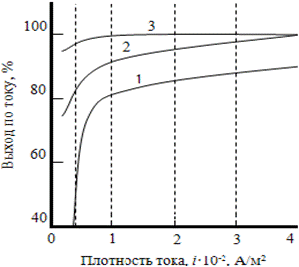
Рис. 3.12. Зависимость выхода никеля
по току из электролита, содержащего 140 г/л NiSO4·7Н2O,
20 г/л NiС12·6Н2О и 25 г/л Н3ВО3, от плотности тока
Условия электролиза:
1 – рН = 1,9, 25 °С; 2 – рН = 1,9, 52 °С;
3 –рН = 5,3, 25 °С
В ходе растворения никелевых анодов наблюдается значительное повышение потенциала вследствие пассивирования. Аноды покрываются сплошной солевой или оксидной пленкой, и растворение никеля сильно замедляется, так как на аноде начинается процесс выделения кислорода. В результате этого концентрация никеля в растворе постепенно снижается, раствор подкисляется, что приводит к нарушению нормального процесса электролиза.
При наличии в электролите хлоридов (NiС12·6Н2О или NаС1) анодная поляризация снижается, и никель растворяется без затруднений. Это связано с тем, что хлориды никеля имеют более высокую растворимость, чем сульфаты, и поэтому солевая пленка на анодах не образуется. Известны специальные непассивирующиеся никелевые аноды, содержащие 0,1–0,2 % кислорода или 0,08–0,3 % углерода и 0,002–0,0030 % серы. Такие аноды растворяются равномерно даже при рН = 6,3.
Кислотность электролита играет существенную роль в процессе выделения никеля на катоде. В сульфатно-хлоридных электролитах выход металла по току резко снижается и преимущественно выделяется водород, так как перенапряжение выделения его на никеле очень низкое. Однако при 70–80 °С выход металла по току в кислой среде остается высоким (75–85 %). Это объясняется тем, что с повышением температуры перенапряжение выделения никеля снижается в большей степени, чем перенапряжение водорода. Повышение температуры улучшает качество осадков (уменьшаются внутренние напряжения в осадке).
При значениях рН > 6 наступает гидролиз солей с образованием гидроксида никеля. Особенно интенсивно этот процесс протекает в прикатодном слое, где происходит подщелачивание раствора вследствие разряда ионов водорода. Накапливаясь, гидроксиды и основные соли никеля сильно ухудшают качество осадков – они становятся темными, хрупкими.
Таким образом, концентрацию ионов водорода в электролите следует выбирать в зависимости от температуры и плотности тока и поддерживать постоянной в определенном интервале, например:
рН =4,5÷5,5 при 18–25 °С.
Для поддержания постоянной кислотности в электролит вводятся буферные добавки – борная, лимонная, уксусная кислоты или их соли. Очень эффективны в этом отношении аминоуксусная и янтарная кислоты (вместе с бурой: по 20–30 г/л), допускающие повышение катодной плотности тока до (20–30)102 А/м2 при рН = 3,5÷4,5 и 50 °С без перемешивания электролита.
Иногда в электролит вводят фториды, которые способствуют регулированию концентрации водородных ионов в электролите и предупреждают образование анодного шлама.
Для повышения электропроводности сульфатно-хлоридного электролита часто добавляют сульфаты щелочных металлов (Nа2SО4, К2SО4) в количестве до 150 г/л. В присутствии этих солей одновременно несколько повышается катодная поляризация.
Блестящие осадки никеля при электрохимическом выделении получаются без дополнительной полировки покрытия из электролитов, содержащих специальные добавки органических веществ. Некоторые из них придают электролиту способность выравнивать микрорельеф покрытия вследствие повышения скорости осаждения никеля в микроуглублениях. Наиболее распространенными добавками в электролиты для никелирования являются 1,4-бутиндиол, хинальдин, сахарин, фталимид. Обычно только сочетание двух-трех блескообразующих и выравнивающих добавок позволяет получать в достаточно широком интервале плотностей тока никелевые осадки с минимальными внутренними напряжениями.
Для успешного проведения процесса необходима постоянная или периодическая фильтрация электролита. Аноды из никеля высокой чистоты следует помещать в чехлы из пропиленовой ткани во избежание попадания в электролит шлама. Условия проведения электролиза выбирают в зависимости от требований к свойствам никелевого покрытия (твердость, пластичность, цвет, блеск, коррозионная стойкость, пористость) или скорости процесса никелирования.
Для получения блестящих осадков никеля с выравниванием рекомендуется электролит состава, в г/л:
NiSO4·7Н2О ……………………………………………… 230–320
NiCI2·6H2O ………………………………………………. 30–60
H3BO3 …………………………………………………….. 25–60
1,4-бутиндиол (100 %) …………………………………. 0,10–0,3
Сахарин ………………………………………………….. 0,3–2,0
Блескообразователь НИБ-3 ……………………………. 6–10
Блескообразователь НИБ-12 …………………………... 0,003–0,015
рН электролита …………………………………………. 3–5,0
Температура, °С ………………………………………... 50–60
Плотность тока, А/м2 …………………………………… 200–700
В качестве материала анода используется чистый никель. При растворении никелевого анода может происходить его пассивирование, в результате чего он перестает растворяться, а на аноде выделяется кислород. Вследствие этого происходит уменьшение концентрации ионов никеля в электролите и увеличение концентрации ионов водорода, что приводит к падению катодного выхода по току и ухудшению качества покрытия. Для предупреждения пассивирования анодов в никелевый электролит вводят активаторы – ионы хлора в виде солей NaCl, КCl, NiCl2.
Для устранения неравномерного растворения никелевых анодов их легируют серой в пределах 0,0002–0,01 %. Депассивирующее действие серы сохраняется при наличии в никелевых анодах углерода или кислорода в концентрации, необходимой для получения плотного слитка (0,1–0,3 %). Такие непассивирующиеся аноды изготавливаются путем литья или вальцовки. Выпуск горячекатанных анодов марок НПА-1 и НПА-2, а также непассивирующихся анодов марки НПАН регламентируется ГОСТ 2132-75.
Во избежание загрязнения электролита анодным шламом никелевые аноды помещают в чехлы из ткани «хлорин» или «бельтинг», предварительно обработанные в 2–10 % растворе соляной кислоты. Все компоненты растворяют отдельно, фильтруют или декантируют и сливают в ванну никелирования. Затем ванну доливают водой до расчетного уровня, проверяют рН, и электролит приготовлен. Наиболее применяемый электролит имеет следующие состав, г/л, и режим работы:
Сернокислый никель (кристаллогидрат) ………………… 250–300
Сернокислый магний ……………………………………… 50–60
Борная кислота …………………………………………….. 25–30
Хлористый натрий ………………………………………….. 3–5
Фтористый натрий ………………………………………….. 2–3
Температура, °С ……………………………………………. 30–40
Плотность тока, А/дм2 ……………………………………… 2–4
рH ……………………………………………………….…… 3–5
При использовании электролитов, содержащих фтористый натрий, непрерывное фильтрование затрудняется засорением фильтровальной ткани коллоидными сгустками фторидов. Для устранения этого явления необходимо поддерживать как можно более низкое значение рН или вводить фтористые соединения в виде борфтористоводородных солей. Указанный электролит устойчив в работе и при правильной эксплуатации и систематической очистке от вредных примесей может использоваться в течение нескольких лет без замены.
Никелевый сернокислый электролит очень чувствителен к загрязнениям. Примеси более положительных металлов (Си, Аs, Sb, Рb, Sn) вызывают образование пятнистых темно-серых и губчатых черных осадков никеля. При загрязнении электролита солями железа осадки никеля становятся хрупкими, растрескивающимися. При содержании в электролите цинка более 0,05 г/л получаются осадки с темными и черными полосами. Допустимая концентрация металлов-примесей в электролите следующая: Fe2+ – 0,1 г/л; Си2+ – 0,02 г/л;
Zn2+ – 0,01 г/л и РЬ2+ – 0,007 г/л. При наличии некоторых органических соединений никелевое покрытие становится хрупким.
Для никелирования характерно явление, называемое питтингом, – типичный вид брака никелевого покрытия. Остатки полировочных паст, клея и других подобных им веществ, увеличивающих поверхностное натяжение, адсорбируясь на никеле, задерживают на катодной поверхности пузырьки выделяющегося газообразного водорода, прилипают к ней. В этих местах становится невозможным дальнейший разряд ионов никеля. На покрытии образуются характерные язвочки, ямки или «водородные макропоры», которые хорошо видны невооруженным глазом или через лупу. Осадок теряет декоративный вид, уменьшается стойкость против коррозии (рис. 3.13).

Рис. 3.13. Поперечный разрез питтинга
 2018-01-08
2018-01-08 6299
6299








