Среди различных тепловых свойств важное место занимает теплоемкость С, под которой для тела (или системы тел) понимают отношение
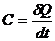 (24.1)
(24.1)
где  - бесконечно малое количество теплоты, полученное системой при повышении температуры на
- бесконечно малое количество теплоты, полученное системой при повышении температуры на 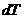 .
.
Средняя теплоемкость 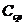 в интервале температур от
в интервале температур от 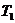 до
до 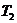 может быть представлена таким образом:
может быть представлена таким образом:
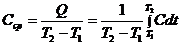 , (24.2)
, (24.2)
где  - количество теплоты, за счет получения которой температура системы повысилась от
- количество теплоты, за счет получения которой температура системы повысилась от 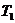 до
до 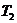 .
.
Так как количество сообщенной теплоты зависит от характера процесса (от пути процесса), определений (24.1) и (24.2) недостаточно, и необходимо указать, каким именно способом повышается температура. Действительно, если температура тела повышается вследствие адиабатического процесса, то  и С=0. Если в системе происходит изотермический процесс, то
и С=0. Если в системе происходит изотермический процесс, то 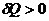 или
или 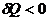 , а
, а 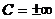 .
.
Обычно на опыте имеют дело с двумя видами теплоемкостей: при постоянном давлении, 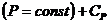 , и при постоянном объеме,
, и при постоянном объеме, 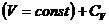 .
.
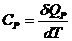 ,
, 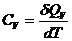 , (24.3)
, (24.3)
где 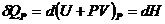 ,
,  - энтальпия, а
- энтальпия, а
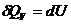 ,
,  - внутренняя энергия, а
- внутренняя энергия, а 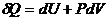 - первое начало термодинамики.
- первое начало термодинамики.
Таким образом, теплоемкости  и
и  есть частные производные от энтальпии и внутренней энергии по температуре (при постоянных давлении и объеме). Уравнения
есть частные производные от энтальпии и внутренней энергии по температуре (при постоянных давлении и объеме). Уравнения
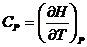 и
и 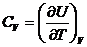 (24.4)
(24.4)
можно рассматривать как определения. Они не имеют прямого отношения к теплоте и характеризуют зависимость энтальпии и внутренней энергии от температуры в условиях постоянного давления или объема и позволяют найти энтальпию или внутреннюю энергию системы при любой температуре, если известны 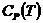 и
и 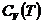 .
.
Теплоемкости  и
и  связаны между собой простым термодинамическим соотношением:
связаны между собой простым термодинамическим соотношением:
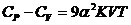 (24.5)
(24.5)
где 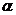 - температурный коэффициент линейного расширения,
- температурный коэффициент линейного расширения,  - модуль всестороннего сжатия (см. определение в работе 1-23),
- модуль всестороннего сжатия (см. определение в работе 1-23), 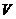 - объем тела,
- объем тела, 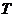 - температура.
- температура.
Относительная величина разности 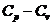 для твердых тел невелика и ею можно пренебречь при невысоких температурах. Напомним, что в газах это не так: (
для твердых тел невелика и ею можно пренебречь при невысоких температурах. Напомним, что в газах это не так: ( ).
).
Чтобы теплоемкость вещества не зависела от массы тела вводят понятие удельной 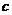 и молярной теплоемкостей
и молярной теплоемкостей 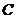 . Удельная теплоемкость измеряется в
. Удельная теплоемкость измеряется в 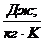 , а молярная – в
, а молярная – в 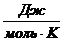 . Из соображений размерности ясно, что
. Из соображений размерности ясно, что 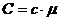 , где
, где  - молярная масса вещества.
- молярная масса вещества.
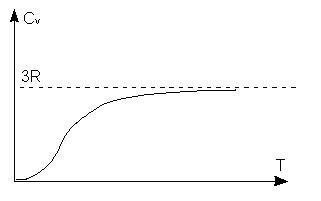
Рис. 24.1
Экспериментальные факты, относящиеся к теплоемкости типичных неорганических, химически простых, одноатомных кристаллических тел, можно свести к следующим пунктам.
1. При комнатных температурах значения теплоемкости таких веществ близки к 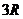 , т.е.
, т.е. 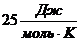 . Это так называемый закон Дюлонга – Пти.
. Это так называемый закон Дюлонга – Пти.
2. При низких температурах теплоемкость заметно уменьшается и в области абсолютного нуля температур приближается к нулю (рис. 24.1).
Эту особенность температурной зависимости теплоемкости твердого тела при низких температурах можно объяснить только с помощью квантовой теории (модели Эйнштейна и Дебая).
Методика измерений
Для экспериментального определения теплоемкости исследуемое тело помещается в калориметр, который нагревается электрическим током. Если температуру калориметра с исследуемым образцом очень медленно увеличивать от начальной 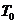 на
на  , то энергия электрического тока пойдет на нагревание образца и калориметра:
, то энергия электрического тока пойдет на нагревание образца и калориметра:
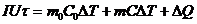 (24.6)
(24.6)
где  и
и  - ток и напряжение нагревателя;
- ток и напряжение нагревателя;  - время нагревания;
- время нагревания;  и
и  - массы калориметра и исследуемого образца;
- массы калориметра и исследуемого образца; 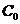 ,
, 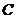 - удельные теплоемкости калориметра и исследуемого образца;
- удельные теплоемкости калориметра и исследуемого образца; 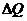 - потери тепла в теплоизоляцию калориметра и в окружающее пространство.
- потери тепла в теплоизоляцию калориметра и в окружающее пространство.
Для исключения из уравнения (24.6) количества теплоты, расходованной на нагрев калориметра и потери теплоты в окружающее пространство необходимо при той же мощности нагревателя нагреть пустой калориметр (без образца) от начальной температуры 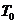 на ту же разность температур
на ту же разность температур  .
.
Потери тепла в обоих случаях будут практически одинаковыми и очень малыми, если температура защитного кожуха калориметра в обоих случаях постоянная и равна комнатной: 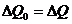
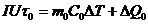 (24.7)
(24.7)
Из уравнений (24.6) и (24.7) вытекает
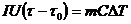 (24.8)
(24.8)
Уравнение (24.8) может быть использовано для экспериментального определения удельной теплоемкости материала исследуемого образца. Изменяя температуру калориметра, необходимо построить график зависимости разности времени нагрева от изменения температуры исследуемого образца: 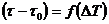 , по угловому коэффициенту которого
, по угловому коэффициенту которого 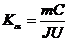 можно определить удельную теплоемкость образца.
можно определить удельную теплоемкость образца.
Экспериментальная часть.
Для определения теплоемкости твердых тел предназначена экспериментальная установка ФПТ1-8, общий вид которой показан на рис. 24.2.
Образцы нагреваются в калориметре, схема которого приведена на рис. 24.3.
Калориметр представляет собой латунный корпус с коническим отверстием, куда вставляется исследуемый образец. На наружной поверхности корпуса в специальных пазах размещается нагревательная спираль. Снаружи корпус калориметра теплоизолирован слоями асбеста и стекловолокна и закрыт алюминиевым кожухом. Калориметр закрывается теплоизолирующей крышкой. Исследуемые образцы расположены в гнездах в блоке рабочего элемента 2. После окончания эксперимента образец можно вытолкнуть из конического отверстия корпуса калориметра с помощью винта. Для удаления нагретого образца из калориметра и установки образца в нагреватель используется рукоятка, расположенная в специальном гнезде рядом с исследуемыми образцами.

Рисунок 24.2 - Общий вид экспериментальной установки ФПТ1-8: 1 - блок приборов; 2 - блок рабочего элемента; 3 - стойка; 4 - нагреватель; 5 - исследуемые образцы.
Температура калориметра измеряется цифровым термометром, датчик которого находится в корпусе калориметра. В блоке приборов 1 расположен источник питания нагревателя, мощность которого устанавливается регулятором «Нагрев». Напряжение и ток в цепи нагревателя измеряется вольтметром и амперметром, расположенными на передней панели блока приборов. Время нагрева калориметра измеряется секундомером, расположенным в блоке приборов. Секундомер приводится в действие при включении питания блока приборов.
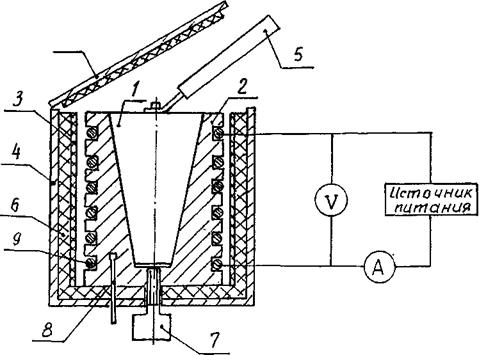
Рисунок 24.3 - Схема калориметра: 1 - образец; 2 - корпус, 3 - асбест; 4 - кожух; 5 - рукоятка; 6 - стекловолокно; 7 - винт; 8 - датчик температуры; 9 - нагреватель; 10 - крышка.
Массы образцов и относительные атомные массы материалов приведены в таблице 24.1.
Таблица 24.1
| № п/п | Материал образца | Атомная масса, кг/моль | Масса, г |
| Дюраль | 26,98 10-3 | ||
| Латунь | 63,57 10-3 | ||
| Сталь | 55,85 10-3 |
 2018-01-08
2018-01-08 795
795








