Теплотою утворення сполуки називається кількість теплоти, яка виділяється або поглинається при утворення одного молю його із простих речовин, які знаходяться в найбільш стійкому стані при певних умовах. Наприклад, теплота утворення карбонату кальцію дорівнює тепловому ефекту реакції утворення одного молю кришталевого карбонату кальцію із металічного кальцію, вуглець в виді графіту і газоподібного кисню:
Са (т) + С (графіт) + 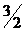 О2 (г) = СаСО3 (кр)
О2 (г) = СаСО3 (кр)
Теплоти (ентальпії) утворення найбільш стійких простих речовин (N2, О2, Н2) прийнято вважати рівними нулю. Звичайно теплоти утворення відносять до стандартних умов: 25 0С (298 К) і 101,3 кПа і називають стандартними теплотами або стандартними ентальпіями утворення, які позначаються DН0298.
По теплоті (ентальпії) утворення можливо розрахувати тепловий ефект будь-якої реакції, так як із закону Гесса випливає, що тепловий ефект реакції дорівнює різниці між теплотами (ентальпіями) утворення продуктів реакції і теплотами (ентальпії) утворення вхідних речовин:
DНх = S (DНутв)кінц - S ((DНутв)вхід
При складанні теплоти утворення речовин, які участують в реакції, необхідно враховувати стехіометричні коефіцієнти.
В якості приклада розглянемо реакцію отримання кристалічного АІ2(SO4)3 при
25 0С із кристалічного АІ2О3 і газоподібного SO3:
АІ2О3 + 3 SO3 = АІ2(SO4)3
Стандартні ентальпії утворення речовин, які приймають участь в певній реакції, складають:
АІ2О3 (кр) DН0298 = -1674, 0 кДж/моль
SO3 (г) DН0298 = -395, 4 кДж/моль
АІ2(SO4)3 (кр) DН0298 = -3439,3 кДж/моль
По рівнянню знаходимо:
DНх = 
DНх = -3439,3 – (- 1674 – 3 × 395,4) = - 579,1 кДж/моль
Для певної реакції при температурі 25 0с і нормальному тиску тепловий ефект дорівнює DНх = -579,1 кД/моль.
Теплотою згорання називається теплота, яка виділяється при повному горінні одного моля речовини в кисні. Для органічних сполук це буде тепловий ефект повного горіння певної сполуки до диоксиду вуглецю, води і вищих оксидів інших елементів.
По закону Гесса тепловий ефект реакції дорівнює різниці між теплотами (ентальпіями) згорання вхідних речовин і теплотами (ентальпіями) згорання кінцевих речовин:
DНх = S (DНгор)вхід - S ((DНгор)кінц
В якості приклада обчислимо тепловий ефект реакції:
3С2Н2 = С6Н6
Ентальпії згорання дорівнюють:
для ацетилену (г)  = -1298,3 кДж/моль
= -1298,3 кДж/моль
для бензолу (р)  = -3264,2 кДж/моль.
= -3264,2 кДж/моль.
По рівняння знаходимо:
DНх = 
DНх = 3 (-1298,3) = 3264,2 = -630,7 кДж/моль
Закон Гесса справедливий не тільки для чисто хімічних реакцій, але й для складних біохімічних процесів. Так, кількість теплоти, яку отримуємо при окисненні вуглеводнів і жирів в живому організмі, де ці процеси протікають в декілька стадій, і кількість теплоти, яка виділяється при горінні цих речовин в кисні, оказалися рівними. Для білків теплоти горіння різноманітні, так як кінцевим продуктом окиснення білка в організмі являється карбамід, в кисні ж окиснення повне.
Завдання для виконання самостійної роботи.
1. Що таке теплота утворення сполук?
2. Які умови притаманні стандартним?
3. Закон Гесса для теплового ефекту будь-якої реакції.
4. Що таке теплота згорання та її характеристика?
5. Для яких реакцій справедливий закон Гесса?
6. Наслідки із закону Гесса.
7. Що таке стандартна ентальпія утворення?
8. Які потрібні довідкові величини для розрахунку теплового ефекту реакції?
9. Для яких процесів справедливий закон Гесса?
10. Що таке енергія зв’язку?
Самостійна робота №5
Тема: Фазові рівноваги, правило фаз, багатоваріантна система, фазові переходи.
 2018-01-08
2018-01-08 1192
1192








