МІНІСТЕРСТВО ОСВІТИ І НАУКИ, МОЛОДІ ТА СПОРТУ УКРАЇНИ
ОДЕСЬКИЙ ТЕХНІЧНИЙ КОЛЕДЖ
ОДЕСЬКОЇ НАЦІОНАЛЬНОЇ АКАДЕМІЇ ХАРЧОВИХ ТЕХНОЛОГІЙ
Методичні вказівки та запитання
до семінарських занять
з предмету: “Фізколоїдна хімія”
для підготовки студентів денного відділення
за спеціальністю: 5.05170104 "Виробництво хліба,
Кондитерських, макаронних
виробів та харчоконцентратів"
М. Одеса - 2011
1. РОЗРОБЛЕНО:
Циклова комісія хімічних дисциплін Одеського технічного коледжу Одеської національної академії харчових технологій.
2. ВИКОНАВЕЦЬ:
викладач фізколоїдної хімії, голова облметодоб’єднання
викладачів хімії Девятьярова Л.І.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ, МОЛОДІ ТА СПОРТУ УКРАЇНИ
ОДЕСЬКИЙ ТЕХНІЧНИЙ КОЛЕДЖ
ОДЕСЬКОЇ НАЦІОНАЛЬНОЇ АКАДЕМІЇ ХАРЧОВИХ ТЕХНОЛОГІЙ
ЗАТВЕРДЖУЮ
Заст. директора з НР
___________В.І.Уманська
“____“___________2011 р.
Методичні вказівки та запитання
до семінарських занять
з предмету: “Фізколоїдна хімія”
для підготовки студентів денного відділення
за спеціальністю: 5.05170104 "Виробництво хліба,
Кондитерських, макаронних
виробів та харчоконцентратів"
Автор: Девятьярова Л.І.
РОЗГЛЯНУТО ТА СХВАЛЕНО
Предметною комісією хімічних дисциплін
Протокол №_________________________
Від “___“_____________________20__ р.
Голова комісії _____________ Швець Л.І.
Одеса – 2011
ЗМІСТ
1. Семінар №1: « Фізична хімія, агрегатний стан речовин.» ……………………… 5
2. Семінар №2: «Основи хімічної термодинаміки»………………………………. 9
3. Семінар №3: « Фазові рівноваги. Розчини, їх властивості»……………………. 13
4. Семінар №4: «Хімічна кінетика, хімічна рівновага, каталіз»……………….. 19
5. Семінар №5: « Електрохімія»………………………………………………….. 24
6. Семінар №6: «Колоїдна хімія, поверхневі явища»…………………………… 28
7. Семінар №7: «Будова міцел, коагуляція, ПАР»………………………………. 32
8. Семінар №8: «Колоїдні ПАР, грубодисперсні системи»……………………. 35
ВСТУП
При вивченні Фізколоїдної хімії студенти зустрічаються з проблемою при підготовці до семінарських занятть в зв’язку з переходом до лекціонно-семінарського методу навчання. Семінарські заняття включають об’ємні теми, які частково вивчаються студентами самостійно.
Методичні вказівки містять основну інформацію з вивчаємих тем, що дає можливість студентам більш досконало підготуватися до семінарського заняття, а перелік питань дає можливість студентам перевірити свої знання з вивчаємої теми.
Методичні вказівки також містять ряд запитань для розвитку логічного мислення студентів та вміння розв’язувати проблемні питання.
Семінар № 1
Тема: Фізична хімія, агрегатний стан речовин.
Мета: Вивчити основні розділи фізичної хімії, навчитися використовувати основні поняття, ознайомитися з загальною характеристикою агрегатного становища.
Вивчити газоподібний стан речовин, навчитися користуватися рівняннями: ідеального, реального та об’єднаним газовим законом, переводити одиниці вимірювання в систему СІ. Вивчити властивості рідини, навчитися визначати поверхневий натяг та в’язкість, встановити залежність поверхневого натягу та в’язкості від концентрації та температури.
Методичні вказівки.
Фізична хімія - наука, яка розкриває фізичні причини хімічних процесів.
М. В. Ломоносов відкрив і кількісно обґрунтував основний закон хімії - "Законзбереження маси речовин". Його дослідження доказали те, що речовину неможливо знищити.
Головні розділи фізичної хімії:
1) Агрегатні стани речовин.
2) Основи хімічної термодинаміки.
3) Хімічна кінетика.
4) Розчини.
5) Електрохімія.
Агрегатні стани речовини.
Газоподібний стан речовин, рівняння ідеального та реального газу.
Газові закони
Газоподібний стан речовини характеризується дуже великою кінетичною енергією молекул і дуже малими силами когезії, тому газ завжди намагається зайняти як можна більший об'єм.
Якщо газ дуже розріджений, міжмолекулярний простір настільки великий, то сили когезії стають настільки малими, що ними можна нехтувати. У таких газах нехтують і об'ємом самих молекул. Такий газ називають ідеальним. Усі газові закони використовують для ідеальних газів.
Ідеальний стан газів вивчали вчені Менделєєв і Клапейрон і вивели рівняння ідеального газу.
PV = nRT
де, Р- тиск, Па (Па = Н/м2)
V- об'єм, м3 (м3 = л ∙10-3)
n – кількість молів газу
R - універсальна газова постійна (R = 8,314 ∙103 кДж/к моль ∙К)
Т - температура, К (00 С = 273 К)
Газ під тиском називають реальним газом. У реальних газах неможливо нехтувати ні об'ємом молекул, ні силами когезії, тому для реальних газів неможливо використовувати рівняння Менделєєва - Клапейрона. Використовують рівняння
Ван-дер-Ваальса:
(Р + n∙a/ V2)∙(V - n∙b) = nRT
де, Р- тиск, Па
n - кількість молів газу
а - коефіцієнт, що враховує сили когезії
V- об'єм, м3
R - газова постійна
b - коефіцієнт, що враховує об'єм молекул.
Ті зовнішні умови (Р, Т, V), при яких газ перетворюється у рідину, називають критичними параметрами. Ці параметри були доведені Д.І. Менделєєвим.
Об'єднаний газовий закон:
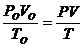
де, Р0= 101325 Па
V0 = 22,4 ∙ 10-3 м3
Т0 = 273 К
При заданих умовах:
rзад = m/V (кг/м3)
При нормальних умовах:
rн.у. = М/V (кг/м3)
Рідкий стан речовини. Поверхневий натяг, в'язкість.
Рідкий стан характеризується більшими силами когезії і малою кінетичною енергією у порівнянні з газоподібними станами речовини.
Усі властивості рідини характеризуються об'ємом самих молекул. Рідини мають свій постійний об'єм, форми постійної вони не мають, цим вони схожі з газом. Також вони схожі з газом та твердим станом, так як займають проміжний стан між ними, рух молекул в рідині поступово-коливальний. Спільність з твердими тілами - пружність.
Рідини текучі, як гази і пружні, як тверді тіла. Рідини, як і тверді тіла, відносять до конденсованих систем.
Молекули, об'єднані у групи, називають асоціатами, а такі рідини - асоційованими.
Властивості рідини:
1) поверхневий натяг;
2) в'язкість.
Поверхневий натяг - поверхнева енергія, віднесена до одиниці площі. Поверхневий натяг визначають за формулою:
s = G/S (Н/м2)
де, s - поверхневий натяг
G - поверхнева енергія
S - площа поверхні
При збільшенні поверхні деяке число молекул переходить з середини на поверхню. Цей процес вимагає затрати зовнішньої роботи.
Поверхнева енергія - робота, витрачена на збільшення площі поверхні рідини, переходить у потенційну енергію молекул поверхневого шару.
В'язкість має велике практичне значення, оскільки треба обов'язково знати в'язкість при розрахунку перетину труб, по яким буде текти рідина. По в'язкості переконуються у готовності напівфабрикату (шоколадної маси, тіста).
В'язкість визначається за формулою Пуазейля:
h = 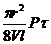 (Па ×с)
(Па ×с)
де, r – радіус капіляра, м
l – довжина капіляра, м
V – об’єм витікаючої рідини, м3
P – тиск, під яким рідина тече через капіляр, Па
t - час протікання, с
На практиці замість абсолютного значення в’язкості знаходять відносну в’язкість (наприклад відносно води) по формулі:
h = h 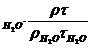 (Па ×с)
(Па ×с)
де, h - в’язкість досліджуваної речовини, Па × с
h 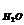 - в’язкість води, Па × с
- в’язкість води, Па × с
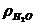 ,
, 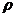 - густина води і досліджованої рідини, кг/м3
- густина води і досліджованої рідини, кг/м3
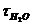 ,
, 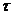 - час витікання води і досліджуваної речовини, с
- час витікання води і досліджуваної речовини, с
Для визначення одиниць вимірювання в'язкості використовують формулу Ньютона, який доказав, що між шарами існує сила, яка намагається зрівняти швидкості руху шарів.
F=h dv/dx ∙S
де, dx/dv – градієнт швидкості
S – площа шарів, які труться
h - коефіцієнт внутрішнього тертя
h = Fdx / Sdv
 2018-01-08
2018-01-08 1413
1413







