Тиск пари над чистим розчинником буде вище, а над розчином нижче. Це було доказано французьким вченим Раулем.
Закон Рауля: «Відносне зниження тиску пари над розчином дорівнює молярній концентрації розчиненої речовини».
Математичний вираз закону:
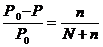
де, Ро-тиск пари над чистим розчинником
Р - тиск пари над розчином
n - кількість молей розчиненої речовини
N - кількість молей розчинника.
Концентрація в молярних частках - це відношення кількості молів розчиненої речовини до суми кількості молів розчиненої речовини і розчиннику:
n / N + n
У теорію розчинів Вант - Гофф вводить поняття ізотонічного коефіцієнту і, який показує, у скільки разів часткова концентрація електроліту більша, ніж часткова концентрація еквімолекулярного розчину неелектроліту.


де, n¢- чаткова концентрація електроліту
n- часткова концентрація неелектроліту;
Ізотонічний коефіцієнт показує, у скільки разів усі фізичні властивості розчинів електролітів яскравіше виражені, ніж фізичні властивості неелектролітів.
і =n¢/n; і =П¢/П; і =DР¢/DР; і = Dtк¢/Dtk; і =Dtз¢/Dtз.
Ізотонічний коефіцієнт знаходиться у такій залежності із ступенем електролітичної дисоціації.
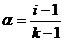 ∙ 100%
∙ 100%
k – величина, яка показує на скільки іонів дисоціює молекула.
Оскільки цей закон використовують для розведених розчинів електролітів, то
n – має маленьке значення і закон Рауля записується так:

DР- зниження тиску пари над розчином:
DР = Р0 – Р
Для розв’язання задач використовують:
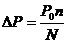
 2018-01-08
2018-01-08 581
581








