Принцип Паулі — квантово-механічний принцип, згідно з яким у багаточастинковій системі невзаємодіючих ферміонів, жодні дві частки не можуть описуватися одночастинковими хвильовими функціями із однаковим набором усіх квантових чисел.
Загалом, атоми можуть мати 2 електрони на s-орбіталях, 6 електронів на p-орбіталях, 10 електронів на d-орбіталях, тощо, чим пояснюється структура періодичної системи елементів.
Уважний розгляд атомних спектрів показує, що лінії, обумовлені переходом між квантовими енергетичними рівнями, насправді розщеплені на більш тонкі, тобто на підоболонки, кожна з своїм енергетичним рівнем.
Наявність у електрона особливої властивості - спіна, також зумовлює розщеплення спектру. Таким чином, енергетичний рівень електрона в атомі визначається чотирма характеристиками: оболонкою, підоболонкою, орбіталлю та спіном. Кожній з цих характеристик відповідає певне квантове число.
Квантові числа електронів Кожен електрон має свій індивідуальний набір квантових чисел, яким він відрізняється від інших електронів даного атома.
Електронна конфігурація елемента - це запис розподілу електронів в його атомах по оболонках, підоболонках та орбіталях. Для визначення конкретної електронної конфігурації елемента в стаціонарному стані є три правила:
Принцип заповнення. Електрони в стаціонарному стані атома заповнюють орбіталі у відповідності підвищення орбітальних енергетичних рівнів. Нижчі за енергією орбіталі завжди заповнюються першими.
Наприклад: Водень 1H 1s1
Розподіл електронів в атомі по енергетичних рівнях Електрон має двоїсту природу: він може поводитися і як частинка, і як хвиля. Електрон у атомі не рухається за певними траєкторіями, а може перебувати в будь-якій частині навколо ядерного простору, проте ймовірність його перебування в різних частинах цього простору неоднакова. Простір навколо ядра, у якому найімовірніше перебування електрона, називається орбіталл ю.
Кожний електрон у атомі перебуває на певній відстані від ядра відповідно до запасу його енергії. Електрони з більш-менш однаковою енергією формують енергетичні рівн і, або електронні шар и.
Число заповнених електронами енергетичних рівнів у атомі даного елемента дорівнює номеру періоду, в якому він розташований.
Число електронів на зовнішньому енергетичному рівні дорівнює номеру групи, вякій розміщений даний елемент.
У межах одного енергетичного рівня електрони можуть відрізнятися формою електронної хмар и, або орбітал і. Існують такі форми орбіталей:
s -форма:
p -форма: 
Існують також d -, f -орбіталі та інші, зі складнішою формою.
Електрони з однаковою формою електронної хмари утворюють однойменні енергетичні підрівн і: s -, p -, d -, f -підрівні.
Кількість підрівнів на кожному енергетичному рівні дорівнює номеру цього рівня.
У межах одного енергетичного підрівня можливий різний розподіл орбіталей у просторі. Так, у тривимірній системі координат для s -орбіталі можливе тільки одне положення:
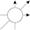
для р -орбіталі — три:

для d -орбіталі — п’ять, для f -орбіталі — сім.
Електрон на схемах позначається стрілкою, яка вказує його спін. Під спіном розуміють обертання електрона навколо своєї осі.
Більше двох електронів на одній орбіталі перебувати не може (принцип Паулі).
Принцип найменшої енергі ї: в атомі кожний електрон розташовується так, щоб його енергія була мінімальною (що відповідає його найбільшому зв’язку з ядром).
Під час отримання додаткової енергії (опромінення, нагрівання) можливе розпарування електронів (промотування). Такий стан атома ще називається збуджени м. При цьому кількість неспарених електронів збільшується і, відповідно, змінюється валентність атома.
Періоди́чна систе́ма елеме́нтів — класифікація хімічних елементів, розроблена на основі періодичного закону.
Сучасне формулювання періодичного закону: властивості елементів перебувають у періодичній залежності від заряду їхніх атомних ядер. Заряд ядра Z дорівнює атомному (порядковому) номеру елемента в системі. Елементи, розташовані за зростанням Z (H, He, Be…) утворюють 7 періодів. Період — сукупність елементів, що починається лужним металом та закінчується благородним газом (особливий випадок — перший період, що складається з двох газоподібних елементів — Н та Не). У 2-у і 3-у періодах — по 8 елементів, у 4-у і 5-у — по 18, у 6-у 32. Вертикальні стовпці — групи елементів з подібними хімічними властивостями. Всередині груп властивості елементів також змінюються закономірно (напр., у лужних металів від Li до Fr зростає хімічна активність
 2018-01-08
2018-01-08 1345
1345








