Спектральні серії атомів водню. При вивченні спектрів атомів водню було виявлено певні закономірності між спектральними лініями. У 1885 р. Й. Бальмер (1825-1898) показав, що довжини хвиль чотирьох ліній видимої частини спектра випромінювання атомів водню можуть бути подані за допомогою емпіричної формули
l = В(n2/ n2-4), (2)
де В = 3645,6´ 10-10 м – емпірична стала; n = 3, 4, 5, 6.
Закономірність, виражена формулою Бальмера (2), стає особливо наочною, якщо цю формулу подати у тому вигляді, в якому нею користуються тепер. Для цього треба перетворити цю формулу так, щоб за її допомогою можна було проводити розрахунки не довжин хвиль, а частот або хвильових чисел. У
практиці спектроскопії переважно застосовують хвильове число – це кількість довжин хвиль, що міщується в 1 см (тобто величина, обернена до довжини хвилі): n0 = 1/l0, де l0 - довжина хвилі у вакуумі. Тоді формулу (2) перепишемо
так:
n0 = 1/l=  =
= 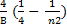 . (3)
. (3)
Сталу 4/ В позначають через R і називають сталою Рідберга. Тоді
n0 = R  . (4)
. (4)
Для атомів водню стала Рідберга R = 10967734,5 м-1. Величина hcR =13,6 еВ – це енергія іонізації атома водню, що являє собою досить зручну одиницю для вимірювання енергії атомних станів.
|
|
|
Вираз (4) – звичайний вигляд формули Бальмера, за допомогою якої легко показати, що зі збільшенням n різниця між хвильовими числами сусідніх ліній зменшується і у випадку n ® ¥ одержуємо постійну величину n0 = R / 4. Крім цього, виявляється, що зі збільшенням номера лінії n її інтенсивність зменшується.
Сукупність спектральних ліній, які у своїй послідовності і в розподілі інтенсивності виявляють певну закономірність, називають спектральною серією. У 1920 р. Р. Вуд у спектрі випромінювання водню виявив 22 лінії серії Бальмера, тепер їх виявлено до 37. Поряд із серією Бальмера в спектрі атомів
водню було виявлено ряд інших серій, розміщення яких виражалось аналогічними формулами. Так, в ультрафіолетовій частині спектра Т. Лайман (1874-1954) відкрив серію
n0 = R  , n = 2,3,4,... (5)
, n = 2,3,4,... (5)
В інфрачервоній області спектра відкрито чотири серії:
Пашена
n0 = R  , n = 4,5,6,... (6);
, n = 4,5,6,... (6);
Бреккета
n0 = R  , n = 5,6,7,... (7);
, n = 5,6,7,... (7);
Пфунда
n0 = R  , n = 6,7,8,... (8);
, n = 6,7,8,... (8);
Хемфрі
n0 = R  , n = 7,8,9,... (9).
, n = 7,8,9,... (9).
Аналізуючи формули (4)-(8), дійдемо висновку, що всі відомі спектральні серії атомів водню можна виразити за допомогою загальної формули
÷n0 = R 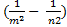 , (10)
, (10)
де m для кожної серії має певне значення (m = 1,2,3,4,5); n – ряд цілих чисел, що починаються з числа, на одиницю більшого за m для даної серії. Формулу (10) називають узагальненою формулою Бальмера. Аналіз узагальненої формули Бальмера (10) показує, що хвильове число будь-якої спектральної лінії атома водню можна виразити як різницю двох функцій від цілих чисел m і n:
n = T (m)- T (n),
де T(m) = R/m2; T(n) = R/n2 – спектральні терми або просто терми. Ця формула виражає комбінаційний принцип Рітца. Він полягає у тому, що коли відомі хвильові числа двох спектральних ліній належать до однієї серії, їх різниця виражає хвильове число деякої третьої лінії спектра цього ж атома. Глибокий зміст цього принципу розкрито після того, як були сформовані постулати Бора. Він вперше вказав на те, що комбінаційний принцип виражає своєрідні квантові закони, які керують внутрішньоатомними рухами.
|
|
|
Теорія атома Бора. Заснована на двох постулатах Бору:
•Атом може знаходитися лише в особливих стаціонарних, або квантових, станах, кожному з яких відповідає певна енергія. У стаціонарному стані атом не випромінює електромагнітних хвиль.
•Випромінювання і поглинання енергії атомом відбувається при стрибкоподібному переході з одного стаціонарного стану в інше, при цьому мають місце два співвідношення:
1.  де
де  — енергія, що випромінює (поглинена),
— енергія, що випромінює (поглинена),  — номери квантових станів. У спектроскопії
— номери квантових станів. У спектроскопії  і
і  називаються термами.
називаються термами.
2. Правило квантування моменту імпульсу: 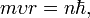
 Далі виходячи з міркувань класичної фізики про круговий рух електрона довкола нерухомого ядра по стаціонарній орбіті під дією кулонівської сили тяжіння, Бором були отримані вираження для радіусів стаціонарних орбіт і енергії електрона на цих орбітах:
Далі виходячи з міркувань класичної фізики про круговий рух електрона довкола нерухомого ядра по стаціонарній орбіті під дією кулонівської сили тяжіння, Бором були отримані вираження для радіусів стаціонарних орбіт і енергії електрона на цих орбітах:
 ,
,  – радіус Бора
– радіус Бора
 ,
,  — энергетическая постоянная Ридберга
— энергетическая постоянная Ридберга
 2018-01-08
2018-01-08 2081
2081








