ПО ТЕМЕ «КИСЛОРОДСОДЕРЖАЩИЕ И
АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ»
Цель: определить опытным путем принадлежность выданных веществ к определенному классу органических соединений с помощью характерных реакций и получить практически заданное органическое соединение.
Оборудование: штатив с пробирками, держатель для пробирок, спиртовка, рН-шкала, универсальная индикаторная бумага.
Реактивы: в пронумерованных пробирках (1 – 3) находятся растворы белка, глюкозы (с массовой долей 1 – 5%), уксусной кислоты (с массовой долей 5 – 6%), глицерина (с массовой долей 10%), растительное масло, мыло (с массовой долей 1%), крахмального клейстера; реактивы для определения указанных веществ (растворы сульфата меди (II), хлорида кальция (с массовой долей 5%), гидроксида натрия (с массовой долей 10%), перманганата калия, бромная вода (с массовой долей (1 – 3%).
G Соблюдайте правила техники безопасности!
Ход работы
Задание 1.
Докажите опытным путем, что прозрачный раствор в пробирке (1) содержит белок.
Задание 2.
Докажите опытным путем, что в составе молекул глюкозы имеются функциональные группы двух различных видов.
Задание 3.
В пронумерованных пробирках (__ ,__,__) находятся бесцветные растворы мыла, глицерина и крахмальный клейстер. Определите опытным путем каждое из предложенных веществ.
Задание 4
Опишите, с помощью каких реакций можно доказать, что аминоуксусная кислота обладает амфотерными свойствами.
| Задание | Выполнение | Наблюдения | Уравнение реакции | Вывод |
| 1. Докажите опытным путем, что прозрачный раствор в пробирке (1) содержит белок |  | |||
| 2. Докажите опытным путем, что в составе молекул глюкозы имеются функциональные группы двух различных видов |  |
| Задание | Выполнение | Наблюдения | Уравнение реакции | Вывод |
| 3. В пронумерованных пробирках (__ ,__,__) находятся бесцветные растворы мыла, глицерина и крахмальный клейстер. Определите опытным путем каждое из предложенных веществ |  | |||
| 4. Опишите, с помощью каких реакций можно доказать, что аминоуксусная кислота обладает амфотерными свойствами |  |
Практическая работа № 5 «____» ____________________ 20_____ г.
ХИМИЧЕСКИЕ РЕАКЦИИ
Цель: закрепить знания о классификации, условиях протекания химических реакций, развивать умения практически осуществлять химические реакции.
Оборудование: пробирки, спиртовка, держатель для пробирок, газоотводная трубка, ложка для сжигания веществ.
Реактивы: цинк,медь (проволока), углерод (уголь), растворы соляной кислоты, гидроксида натрия, серной кислоты, хлорида бария, сульфата меди (II), железный гвоздь, фенолфталеин.
G Соблюдайте правила техники безопасности!
Ход работы
1. Проведите возможные химические реакции между веществами.
2. Составьте уравнения проведенных химических реакций, дайте им характеристику по следующему плану:
1) Соотношение числа и состава исходных веществ и продуктов реакции (соединения, разложения, замещения, обмена);
2) Изменение степени окисления атомов (окислительно-восстановительная (ОВР), без изменения степени окисления);
3) По выделению или поглощению энергии (экзотермическая, эндотермическая);
4) Направлению протекания реакции (обратимая, необратимая);
5) Участию катализатора (каталитическая, некаталитическая);
6) Наличию раздела фаз в реакционной среде (гомогенная, гетерогенная).
3. Для уравнений окислительно-восстановительных реакций составьте электронный баланс.
4. Результаты опытов занесите в таблицу.
| Задание | Наблюдения | Уравнение химической реакции (в молекулярном, ионном виде или электронный баланс) | Характеристика реакции |
| 1. Прокалите в пламени спиртовки зачищенную медную проволоку | Проволока покрывается черным налетом | 2Cu0(тв.)+ 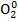 (г.) (г.)  2Cu+2O‒2(тв.) Сu0 – 2ē → Cu+2 2 2 восстановитель 2Cu+2O‒2(тв.) Сu0 – 2ē → Cu+2 2 2 восстановитель  + 2∙2ē → 2O‒2 4 1 окислитель + 2∙2ē → 2O‒2 4 1 окислитель | 1) соединения 2) ОВР 3) экзотермическая 4) необратимая 5) некаталитическая 6) гетерогенная |
| 2. Проведите реакцию взаимодействия цинка с соляной кислотой | 1) 2) 3) 4) 5) 6) | ||
| 3. Проведите реакцию взаимодействия хлорида бария с серной кислотой | 1) 2) 3) 4) 5) 6) | ||
| 4. В ложечке для сжигания веществ подожгите измельченный уголь | 1) 2) 3) 4) 5) 6) | ||
| 5. Проведите реакцию нейтрализации гидроксида натрия (предварительно добавьте 2–3 капли фенолфталеина) серной кислотой. | 1) 2) 3) 4) 5) 6) | ||
| 6. В пробирку с сульфатом меди (II) поместите железный гвоздь (скрепку, кнопку). | 1) 2) 3) 4) 5) 6) | ||
| 7. Поместите в пробирку немного оксида кальция, прилейте к нему раствор соляной кислоты. | 1) 2) 3) 4) 5) 6) |
5. Сделайте вывод о способах классификации химических реакций.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
 2018-01-08
2018-01-08 3891
3891








