1. Укажите агрегатное состояние при комнатной температуре следующих веществ:
H2O(______), CO2 (______), CaCO3 (____), Zn (____), Cu (_____), C (_____), Na2CO3(___), H2SO4(_____).
2. Определите степени окисления атомов в следующих веществах:
HCl, H2SO4, Zn, ZnSO4, ZnCl2, CO2, H2O, CuO, Na2CO3, Na2SO4, CuSO4.
3. В уравнении реакции H2SO4 (…) + Zn(…) → ZnSO4(…) + H2(…)↑+Q укажите агрегатное состояние веществ, степени окисления атомов и дайте полную характеристику реакции по всем признакам классификации.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Практическая работа № 6 «____» ___________________ 20____ г.
ИЗУЧЕНИЕ СВОЙСТВ КИСЛОТ, ОСНОВАНИЙ И СОЛЕЙ
В СВЕТЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Цель: закрепить знания о свойствах электролитов, развивать умение исследовать свойства веществ, анализировать результаты химического эксперимента, делать выводы, следующие из проведенных экспериментальных исследований.
Оборудование: пробирки, рН-шкала, индикаторная бумага.
Реактивы: железный гвоздь, медь, цинк, соляная кислота, карбонат кальция, растворы карбоната натрия, сульфата калия, гидроксида натрия, хлорида железа (III), хлорида бария, сульфата меди (II), хлорида натрия, нитрата серебра, серной кислоты, индикаторов.
G Соблюдайте правила техники безопасности!
Ход работы
I. Изучение свойств кислот
Задание 1. Взаимодействие кислот с металлами и солями
1. Исследуйте, с какими из предложенных веществ: медь, цинк, карбонат натрия, сульфат калия, нитрат серебра, хлорид бария взаимодействует соляная кислота. Результаты исследований занесите в таблицу 1.
II. Изучение свойств щелочей
Задание 1. Взаимодействие щелочей с солями.
1. В пробирку налейте раствор гидроксида кальция объемом 1 – 2 см3. И прилейте к нему примерно такой же объем карбоната натрия. Наблюдения занесите в таблицу 2.
Задание 2. Взаимодействие щелочей с солями с образованием нерастворимых оснований.
1. В пробирку с раствором хлорида железа (III) по каплям прибавляйте раствор гидроксида натрия до появления признаков реакции. Наблюдения занесите в таблицу 2.
III. Изучение свойств солей
Задание. Взаимодействие солей со сложными веществами
1. Проведите химические реакции, позволяющие осадить катионы металла и анионы кислотного остатка, которые содержатся в растворе сульфата меди (II).Наблюдения занесите в таблицу 3.
Таблица 1
| Вещество | Наблюдения | Уравнение реакции (в молекулярном и ионном виде) | Вывод |
| Цинк | |||
| Медь | |||
| Карбонат натрия _______ | |||
| Сульфат калия _________ | |||
| Нитрат серебра ________ | |||
| Хлорид бария |
Таблица 2
| Задание | Наблюдения | Уравнение реакции (в молекулярном и ионном виде) | Вывод |
| 1. Взаимодействие щелочей с солями | |||
| 2. Взаимодействие щелочей с солями с образованием нерастворимых оснований |
Таблица 3
| Задание | Наблюдения | Уравнение реакции (в молекулярном и ионном виде) | Вывод |
| 1. В первую пробирку в раствор сульфата меди (II) добавьте небольшое количество раствора гидроксида натрия | |||
| 2. Во вторую пробирку с раствором сульфата меди (II) добавьте немного раствора хлорида бария |
Вывод:
1. Сделайте вывод о свойствах кислот как электролитов.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Сделайте вывод о свойствах щелочей как электролитов.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Сделайте вывод о том, с помощью каких реакций можно осадить катионы меди (II) и сульфат-анионы из раствора сульфата меди (II).
______________________________________________________________________________________________________________________________________________________________________________________________________________________________
Решите задачу:
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
| Дано: | Решение: _____________________________________________________ _____________________________________________________ |
| _____________________________________________________ |
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Практическая работа №7 «___» ____________________20___г.
РЕШЕНИЕ ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ
ПО ТЕМЕ «НЕМЕТАЛЛЫ»
Цель: закрепить знания о свойствах неметаллов, развивать умение исследовать свойства веществ, анализировать результаты химического эксперимента, делать выводы, следующие из проведенных экспериментальных исследований.
Оборудование: пробирки, спиртовка, держатель для пробирок.
Реактивы: рН-шкала, универсальная индикаторная бумага, соляная кислота, сульфат натрия, карбонат натрия; растворы карбоната натрия, сульфата натрия, гидроксида натрия, хлорида бария, серной кислоты, нитрата серебра, фенолфталеин.
G Соблюдайте правила техники безопасности!
Ход работы
Задача 1
В пронумерованных пробирках находятся твердыекарбонат натрия и сульфат натрия. При помощи качественных реакций определите выданные вам вещества.
Перед началом работы проверьте выданные вам соли на растворимость в воде. Затем проведите качественные реакции на анионы, находящиеся в растворе.
Результаты исследований занесите в таблицу 1, указав признаки химических реакций. Составьте уравнения соответствующих реакций в молекулярном и ионном виде. Если реакция не возможна, в соответствующей графе поставьте прочерк.
Задача 2
Проведите реакции, позволяющие доказать качественный состав серной кислоты. Исследуйте рН раствора. Составьте уравнения реакции определения сульфат-иона в растворе. Результаты исследований занесите в таблицу 2.
Задача 3
1) Нейтрализуйте выданный вам раствор гидроксида натрия раствором соляной кислоты (в присутствии индикатора фенолфталеина). Составьте уравнение химической реакции в молекулярном и ионном виде. Результаты занесите в таблицу 3.
2) Рассчитайте, хватит ли раствора ___________ кислоты массой ___г с массовой долей кислоты ___% для нейтрализации раствора щелочи ____________массой ____ г с массовой долей щелочи ___%.
| Дано: т р-ра кислоты = ___г ω (кислоты) = ___ % m р-ращелочи = ___ г ω (щелочи) = ___% | Решение: 1. Записываем уравнение химической реакции. 2. По уравнению определяем химическое количество веществакислоты, необходимое для нейтрализации рассчитанного количества щелочи. 3. Сравниваем химическое количество вещества кислоты, необходимое для нейтрализации щелочи, с химическим количеством, данным по условию и отвечаем на вопрос задачи. |
| п (HCl) -? |
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задача 4.
К раствору массой 200 г с массовой долей HCl 7,3% добавили 150 г раствора, содержащего 8% гидроксида натрия. Рассчитайте химические количества исходных веществ и массу образовавшейся соли.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________
Таблица 1
| Номер пробирки | Реактив | Наблюдения | Уравнение реакции (в молекулярном и ионном виде) | Вывод (название и формула вещества) |
| Соляная кислота | ||||
| Хлорид бария | ||||
| Окрашивание пламени сухой солью | ||||
| Соляная кислота | ||||
| Хлорид бария | ||||
| Окрашивание пламени сухой солью |
Таблица 2
| Определяемый ион | Качественный реактив | Наблюдения | Уравнение реакции (в молекулярном и ионном виде) | Вывод |
| Катион Н+ | ||||
Анион 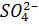 |
Таблица 3
| Задание | Наблюдения | Уравнение реакции (в молекулярном и ионном виде) | Вывод |
| Нейтрализуйте раствор гидроксида натрия раствором соляной кислоты в присутствии фенолфталеина. |
Практическая работа № 8 «____» ________________ 20___ г.
 2018-01-08
2018-01-08 1182
1182
