Диагностическая торакотомия показана больным с очаговым поражением лёгкого, когда совокупность результатов перечисленных выше методов не позволяет исключить рак. Удельный вес этой операции среди всех торакотомий по поводу рака лёгкого составляет 10%. У каждого второго пациента выявляют относительно ранние (I—II) стадии заболевания, что даёт возможность у 90% больных выполнить органосохраняющую операцию. С целью морфологической верификации характера процесса во время операции выполняют пункцию или «тотальную биопсию» (плоскостная, клиновидная, сегментарная резекции). Срочное интраоперационное гистологическое исследование более информативно, чем цитологическое. В последние годы эту операцию заменяет видеоторакоскопия с аналогичными результатами. Следует отметить, что длительное динамическое наблюдение в сомнительных случаях нецелесообразно, поскольку диагностическая видеоторакоскопия или торакотомия менее опасны, чем угроза пропустить ранний рак лёгкого.
С целью уточняющей диагностики, т.е. определения символов N и М, применяют по показаниям дополнительные методы исследования в зависимости от поставленной задачи. Последовательность их применения должна планироваться по принципу: от простых методик к более сложным. В задачу клинициста входит составление правильного индивидуального плана обследования, который включал бы минимальное количество диагностических процедур и одновременно обеспечивал бы необходимую информацию для верификации диагноза рака лёгкого, стадирования (включая систему TNM) и выработки оптимальной лечебной тактики.
Дифференциальная диагностика
Дифференциальный диагноз рака лёгкого необходимо проводить с большим количеством заболеваний лёгких, средостения, плевры и грудной стенки. Наиболее часто приходится его дифференцировать с хронической неспецифической пневмонией, нагноительными процессами в лёгких, туберкулёзом, доброкачественными опухолями, паразитарными кистами, очаговым пневмосклерозом и метастазами опухолей другой локализации. Большое значение имеет сопоставление клинической симптоматики с результатами рентгенологического, бронхологического и цитологического исследований. При сомнении в доброкачественности опухоли больному показана диагностическая видеоторакоскопия или торакотомия.
Лечение
Лечебная тактика при раке лёгкого в силу биологических особенностей заболевания и многообразия морфологических типов неоднозначна. Для правильного выбора метода лечения следует знать основные факторы прогноза: стадию заболевания в соответствии с Международной классификацией по системе TNM, гистологическую структуру опухоли и степень анаплазии, характер и тяжесть сопутствующих заболеваний, функциональные показатели жизненно важных органов и систем. Метод лечения сам по себе является одним из решающих прогностических факторов, значение которого тем больше, чем ближе вариант к радикальному. При лечении больных немел-коклеточным раком лёгкого применяют следующие методы: хирургическое лечение, лучевая терапия, химиотерапия, комбинированное лечение (операция и лучевая терапия или химиотерапия), химиолу-чевое лечение. В стадии клинической апробации находится иммунотерапия, особенно в сочетании с другими методами.
Хирургическое лечение
Хирургическое лечение больных с резектабельными формами рака лёгкого представляется наиболее радикальным методом, дающим реальные перспективы полного излечения. Основные условия радикализма операции — удаление единым блоком лёгкого или доли и регионарно зависимых лимфатических узлов с окружающей клетчаткой в пределах здоровых тканей; отстояние линии пересечения бронха на 1,5-2 см от видимого края опухоли; отсутствие опухолевых клеток в краях пересечённых бронха, сосудов и дополнительно резецированных органов и тканей.
При резектабельных формах немелкоклеточного рака лёгкого (1-Ш стадии) хирургическое лечение является методом выбора. Под уточнением показаний к операции при раке лёгкого имеют в виду не столько определение целесообразности, сколько установление принципиальной возможности выполнения хирургического пособия, что достигается путём оценки противопоказаний.
Абсолютными онкологическими противопоказания к операции на лёгком при раке служат морфологически потверждённые метастазы в отдалённых органах (исключая надпочечник и головной мозг) и лимфатических узлах; обширное прорастание опухоли или метастазов в аорту, верхнюю полую вену, пищевод и противоположный главный бронх, не позволяющее выполнить их резекцию; метастатическое поражение париетальной плевры со специфическим канцероматозным плевритом. Комбинированная операция с резекцией бифуркации трахеи, предсердия, пищевода, аорты, верхней полой вены нередко позволяет выполнить радикальное оперативное вмешательство.
Среди противопоказаний к оперативному вмешательству наибольшее значение придают функциональной недостаточности жизненно важных органов и систем больного, т.е. «функциональной неоперабельное™»: декомпенсированная сердечная недостаточность II и III степеней; выраженные органические изменения в сердце, гипертоническая болезнь III степени, почечная или печёночная недостаточность. Перечисленные противопоказания имеют относительный характер, поскольку необоснованный отказ от операции может лишить больного перспектив выздоровления. Современные возможности анестезиологии и интенсивной терапии позволяют предотвратить нарушения функций органов и систем, особенно при адекватной предоперационной подготовке. Отказ от операции с онкологических позиций также должен быть серьёзно мотивирован. Этот вопрос нео-ходимо решать коллегиально с обязательным участием торакального хирурга, имеющего опыт хирургического лечения рака лёгкого.
Основными операциями при раке лёгкого являются пневмонэкто-мия и лобэктомия, а также их варианты (расширенная и комбинированная операции, лобэктомия с циркулярной резекцией бронхов и др.). Бронхопластические операции расширяют возможности хирургического метода и способствуют повышению резектабельности, составляющей не более 20% среди впервые выявленных больных раком этой локализации. Выбор объёма и характера операции зависит от локализации и распространённости первичной опухоли, её отношения к окружающим органам и структурам, состояния внутригрудных лимфатических узлов.
При ранних формах центрального рака лёгкого (carcinoma in situ, микроинвазивный рак) в последние годы проводят фотодинамическую терапию. После введения фотосенсибилизатора (гидроксиалю-миния трисульфофталоцианин и др.), который накапливается в раковых клетках, с помощью бронхоскопа осуществляют облучение опухоли лучом лазера определённой длины волны. Полученные удовлетворительные отдалённые 5-летние результаты свидетельствуют о перспективности такого метода радикального лечения без торакотомии.
При периферическом раке лёгкого и размерах опухоли до 3 см допустима экономная сублобарная резекция — классическая сегментэк-томия с раздельной обработкой элементов корня сегмента, обязательной ревизией лёгочных и бронхопульмональных лимфатических узлов и срочным морфологическим исследованием. При выявлении в них метастазов минимальным объёмом операции должна быть лобэкто-мия. В последние годы также выполняют видеоторакоскопические операции типа сублобарной резекции без торакотомии или с видео-ассистированной миниторакотомией, особенно при необходимости лобэктомии. Метод находится в стадии клинических испытаний.
Операции на лёгких таят много опасностей, что иногда приводит к интраоперационным и/или послеоперационным осложнениям, а также послеоперационной летальности. Совершенствование оперативной техники и анастезиологического пособия, а также проведение комплексной интенсивной терапии до и в раннем периоде после операции способствовали в последние годы снижению частоты послеоперационных осложнений." в ведущих торакальных клиниках она не превышает 20% при уровне летальности около 3%.
Лучевое лечение
Лучевое лечение немелкоклеточного рака лёгкого осуществляют по радикальной программе или с паллиативной целью. Радикальная лучевая терапия предусматривает получение длительного и стойкого эффекта в результате гибели всех клеток первичной опухоли и внутригрудных метастазов. При малодифференцированных формах рака в поле облучения включают и надключичные зоны.
Лучевую терапию проводят с помощью дистанционных гамма-установок, бетатрона и линейных ускорителей, генерирующих тормозное и электронное излучение. С целью увеличения радиочувствительности опухоли применяют так называемые радиомодификаторы: гипербарическую оксигенацию, искусственную гипертермию, метро-нидазол и др. С целью повышения устойчивости нормальных тканей облучение проводят в условиях гипоксии.
Лучевая терапия по радикальной программе (суммарная очаговая доза не менее 60-80 Гр) возможна у больных раком лёгкого I—II стадии, которым хирургическое лечение противопоказано или которые отказались от него. Лучевую терапию по паллиативной программе (суммарная очаговая доза не более 45 Гр) планируют при раке лёгкого III стадии.
Противопоказаниями к лучевому лечению обычно являются: обильное кровохарканье или кровотечение, опухолевый плеврит, множественные отдалённые метастазы, обширное прорастание первичной опухоли или метастазов в сосуды средостения, пищевод, трахею, лейкопения (менее 3-109/л), тромбоцитопения (ниже 10 109/л), тяжёлая стенокардия, инфаркт миокарда, декомпенсированные формы лёгочно-сердечной, сердечно-сосудистой, печёночной и почечной патологии.
Лучевая терапия сопровождается общими и местными лучевыми реакциями и осложнениями. При лучевом пневмоните лечение прекращают и проводят активную терапию антибиотиками, сульфаниламидными препаратами, глюкокортикоидами, витаминами и др. Эзофагит требует лечения спазмолитиками, диетой, приёмом внутрь алгелдрата + магния гидроксида + бензокаина, оливкового масла и т.д. Развитие эзофагита является поводом для коррекции полей облучения. Симптомы общей лучевой реакции (общая слабость, снижение аппетита, нарушение сна, лейко- и тромбоцитопения, анемия, нарушения со стороны сердечно-сосудистой системы) обычно носят временный характер и требуют соответствующего лечения. Для их профилактики применяют витамины групп А, В, С, антигистамин-ные препараты, бронхолитические средства.
Непосредственный эффект лучевого лечения зависит от распространённости процесса, гистологической структуры опухоли, величины суммарной очаговой дозы, т.е. облучения по радикальной или паллиативной программе. У половины больных удаётся добиться резорбции опухоли, у 40% — уменьшения первичной опухоли и регионарных метастазов.
Химиотерапия
Химиотерапию при немелкоклеточном раке лёгкого проводят при противопоказаниях к хирургическому и лучевому лечению. Полихимиотерапию проводят следующими препаратами в различных сочетаниях: доксорубицин, цисплатин, винкристин, этопозид, цик-лофосфамид, метотрексат, блеомицин, нитрозометилмочевина, ви-норелбин, паклитаксел, доцетаксел, гемцитабин и др. Обычно проводят до 6 курсов химиотерапии с интервалами 3—4 нед.
Объективное улучшение (частичная резорбция первичной опухоли, регионарных и отдалённых метастазов) наступает у 6-30% больных, однако полная резорбция наступает редко. Химиотерапия малоэффективна при метастазах в костях, головном мозге и печени.
Лучшие результаты достигаются при сочетании химиотерапии с лучевым лечением, при этом возможно одновременное или последовательное их применение. Химиолучевое лечение основано на возможности получения как аддитивного эффекта, так и синергизма, без суммации побочного токсического действия.
К возможным ранним токсическим реакциям при химиотерапии относятся тошнота, рвота, энтерит, диарея, флебит, цистит, дерматит и др. Наиболее частым поздним осложнением является угнетение кроветворения. Поэтому анализы крови повторяют не реже 2 раз в неделю и в течение 2 нед после завершения химиотерапии.
При раке лёгкого, осложнённом метастатическим плевритом, после эвакуации жидкости оправдано внутриплевральное введение хи-миопрепаратов (циклофосфамид, цисплатин), хлорохин по 250 мг (3—4 введения) ежедневно или через день, тетрациклина в дозе 1 г. Повторные курсы лечения проводят по мере накопления жидкости в плевральной полости. В случаях объективного эффекта целесообразно проводить системную полихимиотерапию или химиолучевое лечение.
Комбинированное лечение
Повышение эффективности хирургического лечения больных немелкоклеточным раком лёгкого И— III стадии связано с разработкой методов комбинированного лечения, предусматривающего сочетание радикальной операции с лучевой терапией либо с лекарственным противоопухолевым лечением, или иммунотерапией. Дополнительные методы применяют до или после операции, во время неё, а также в пред- и послеоперационном периодах.
Прогноз
Прогноз результатов лечения больных немелкоклеточным раком
лёгкого весьма сложен. Лечебная тактика вследствие биологических особенностей заболевания и многообразия гистологических структур неоднозначна. Хирургическое лечение даёт возможность излечить больного. Среди оперированных больных средний показатель 5-летней выживаемости составляет около 35%. Основными факторами прогноза являются стадия заболевания, гистологическая структура опухоли и степень дифференцировки, радикальность лечения (рис. 28-5).
При IA—IB стадии (Т1—2N0M0) хирургический метод позволяет добиться излечения 70-80% больных, т.е. операция радикальна не только в клиническом, но и в биологическом смысле слова. Предпочтительны органосохраняющие, функционально щадящие операции — лобэктомия, нередко с резекцией и пластикой бронхов, при периферическом раке — сублобарная резекция типа классической сегментэктомии с обязательным удалением клечтатки и лимфатических узлов регионарных зон. При микроинвазивном и прединвазив-ном раке (carcinoma in situ) более 5 лет живут 90% больных. При этих формах допустима эндоскопическая хирургия в виде лазерной или фотодинамической терапии.
При ПА и ПВ стадиях (Т1—2N1M0, T3N0M0) оперативное вмешательство позволяет продлить жизнь на 5 лет и более 50% больных. При невозможности хирургического лечения применяют лучевую или химиолучевую терапию по радикальной программе, но 5-летняя выживаемость больных не превышает 15%. При периферическом раке допустима лоб(билоб)эктомия, а при центральном раке — с резекцией и пластикой бронхов. Медиастинальная лимфаденэктомия является обязательным элементом операции.
При ША или ШБ стадии прогноз после хирургического лечения неудовлетворительный, более 5 лет живут 15—25% больных. Распространённость процесса требует выполнения больших операций типа расширенной, комбинированной пневмонэктомии с резекцией бифуркации трахеи, перикарда, предсердия, грудной стенки, пищевода, верхней полой вены, аорты и др. Лучшие результаты отмечают при плоскоклеточном раке, чем при железистом или крупноклеточном. Выживаемость больных выше при высокодифференцированных формах рака, свыше 5 лет живут около 30% больных. Сочетание операции с лучевой терапией или химиотерапией способствует уменьшению частоты внутригрудного рецидива и увеличению 5-летней выживаемости больных на 10%.
Методы консервативной противоопухолевой терапии уступают хирургическому. Отдалённые результаты колеблются в значительных пределах и зависят от методики облучения, контингента больных с разной распространённостью процесса. Более 3 лет после лучевой терапии живут 4—28%, более 5 — не свыше 1—14,5%. Существенными факторами прогноза являются гистологическая структура опухоли, непосредственный эффект и величина суммарной очаговой дозы. После химиотерапии все больные погибают в сроки до 3 лет.
При немелкоклеточном раке лёгкого IV стадии возможна лишь лекарственная противоопухолевая или симптоматическая терапия.
Мелкоклеточный рак лёгкого характеризуется быстрым развитием, ранним интенсивным лимфогенным и гематогенным метастазирова-нием и плохим прогнозом. У 80—90% больных диагностируют распространённый опухолевый процесс. Поэтому многие годы мелкоклеточный рак считали «терапевтическим» и противопоказанием к хирургическому лечению.
В настоящее время при I—II стадиях, особенно неовсяноклеточ-ном морфологическом подтипе, общепризнана тактика хирургического лечения с последующей полихимиотерапией (до 6 курсов), а также целесообразность неоадъювантной полихимиотерапии (2—4 курса при III стадии с послеоперационной химиотерапией. При мелкоклеточном раке III стадии с поражением средостенных лимфатических узлов (N2) проводят химиолучевое лечение с повторными курсами полихимиотерапии. Современные методики такого лечения позволяют у 80—90% больных получить непосредственный объективно регистрируемый эффект, у 20-50% из них — полную регрессию опухоли. Достижение полной клинической ремиссии после основного курса лечения увеличивает выживаемость больных и открывает перспективу излечения.
Аутотрансплантация костного мозга, стволовых костномозговых клеток периферической крови и применение колониестимулирую-щих факторов (например, молграмостим) способствуют повышению интенсивности химиотерапии, увеличению процента полных ремиссий и 2-летней выживаемости. После 2-3 курсов эффективной полихимиотерапии нередко проводят лучевую терапию.
По сводным данным отечественных и зарубежных публикаций при мелкоклеточном раке I стадии 5-летние благоприятные исходы после хирургического лечения составляют около 25%, адьювантная полихимиотерапия способствует улучшению результатов до 47%, при II стадии — 11,0 и 28,7%, III стадии — 5,0 и 12,9% соответственно. Хи-миолучевая и/или полихимиотерапия способствует продлению жизни больных мелкоклеточным раком лёгкого III стадии, из них единичные (до 5%) пациенты живут 5 лет и более. При IV стадии этого вида рака лёгкого оправдано проведение полихимиотерапии, но прогноз плохой.
Профилактика
Согласно терминологии ВОЗ, профилактические мероприятия предусматривают первичную и вторичную профилактику.
• Первичной (онко-гигиенической, иммунобиологической, закона-дательно-правовой) профилактикой является система государственных и медицинских мероприятий, направленных на устранение или резкое уменьшение воздействия на организм веществ и факторов, признаваемых в настоящее время канцерогенными и играющих значительную роль в возникновении и развитии злокачественного процесса. Основной целью гигиенической профилактики рака лёгкого является борьба с загрязнением вдыхаемого воздуха или хотя бы уменьшение степени его загрязнения, борьба с производственными (профессиональными) вредностями и крайне вредной привычкой — курением табака.
• Вторичная, или медицинская, профилактика предусматривает планово-организационную систему обследования (диспансеризацию) населения с целью выявления, учёта и лечения фоновых процессов и предопухолевых заболеваний лёгких — факторов повышенного риска рака лёгкого. К категории «повышенного риска» относят пациентов, болеющих хроническим бронхитом, пневмонией или туберкулёзом, длительно курящих мужчин в возрасте 50 лет и старше, а также излеченных от злокачественного заболевания. Диспансерное наблюдение с периодическим обследованием этого контингента больных направлено одновременно на выявление истинно ранних форм рака лёгкого, лечение которых даёт хорошие отдалённые результаты.
СЕРДЕЧНО-СОСУДИСТАЯ
ХИрУРГИЯ
За последние 25 лет хирургия сердца и сосудов из нового небольшого раздела хирургии превратилась в одну из основных областей медицины, сохраняющую сотни тысяч жизней и восстанавливающую трудоспособность миллионов больных, страдающих сердечно-сосудистыми заболеваниями. Сегодня кардиоваскулярная хирургия — сложная научно-практическая дисциплина, интегрирующая комплекс вполне самостоятельных клинических направлений. Среди них хирургия врождённых и приобретённых пороков сердца, ишемической болезни сердца и нарушений сердечного ритма, трансплантация донорского и имплантация искусственного сердца, ангиохирургия и флебология, эндо-васкулярная сердечно-сосудистая хирургия и некоторые другие.
Глава 20 ВРОЖДЁННЫЕ ПОРОКИ СЕРДЦА И КРУПНЫХ СОСУДОВ
Врождённые пороки — изменения нормального строения сердца и магистральных сосудов, возникающие вследствие нарушения внутриутробного развития и незавершённости анатомического строения сердца при окончательном формировании постнатального кровообращения. Пороки развития сердца и крупных сосудов выявляют почти у 0,5% детей, родившихся живыми, и у 0,2 % детей, оставшихся в живых после первых 2 лет жизни.
Аномалии развития сердца и крупных сосудов приводят к нарушениям гемодинамики, обусловленным различными причинами, которые определяют клиническую картину порока и методы его коррекции. Основным признаком большинства врождённых пороков сердца бывает отсутствие строгого разделения на системы малого и большого кругов кровообращения, обусловленное наличием дефекта в перегородках или сохраняющимся эмбриональным соустьем. Реже встречают врождённые пороки сердца с необычным отхожде-нием или впадением крупных сосудов, а также сужением аорты или лёгочного ствола. Учитывая основные патологоанатомические признаки и характер нарушения внутрисердечной гемодинамики, условно их можно объединить в три большие группы.
• I группа — пороки, имеющие внутрисердечное патологическое сообщение со сбросом венозной крови в артериальное русло (пороки синего типа: тетрада и триада Фалло, комплекс Эйзенменгера, транспозиция сосудов).
• II группа — пороки с внутрисердечным сообщением (или в пределах начальной части крупных сосудов) и сбросом артериальной крови в малый круг кровообращения (пороки бледного типа: открытый артериальный проток, дефекты межпредсердной, межжелудочковой и аортолёгочной перегородок).
• III группа— пороки без смешивания венозной и артериальной крови, при которых нарушения гемодинамики вызваны сужением магистральных сосудов (сужение лёгочного ствола, стеноз устья аорты, коарктация аорты).
Известно более 100 врождённых пороков сердца и крупных сосудов, а также их сочетаний. Наибольшее клиническое и практическое значение имеют некоторые из них, выявляемые достаточно часто. Зная их симптоматологию, можно распознать или заподозрить другие аномалии развития сердца и крупных сосудов.
Специальные методы исследования сердца и крупных сосудов
Зондирование (катетеризация) сердца — метод исследования при помощи введения в камеры сердца специальных рентгеноконтраст-ных зондов. В зависимости от поставленных задач зондирование проводят через венозные или артериальные сосуды. Метод позволяет измерять давление в полостях сердца, производить его запись в виде кривой для последующего анализа и расчётов, брать пробы крови для изучения газового состава. Возможно также определение патологического сообщения между полостями при прохождении зонда через дефект в перегородке. Путём введения через катетеры контрастных веществ возможно рентгеноконтрастное исследование камер сердца и сосудов (киноангиокардиография). Продвижение контрастного вещества по ходу тока крови даёт возможность получать последовательные изображения всех сосудов и полостей сердца. На основе этих данных составляют представление об анатомической и гемодинами-ческой сущности порока сердца.
Всё большее развитие получают неинвазивные методы исследования (УЗИ, КТ, МРТ, сцинтиграфия). Современную диагностику патологии сердца трудно представить без УЗИ. Под термином «эхо-кардиография» понимают комплексное УЗИ, включающее различные методы: одномерную, двухмерную, допплеровскую эхокардиографию и контрастную эхокардиографию, а также цветное допплеровское картирование. Усовершенствование эхокардиографического исследования привело к появлению чреспищеводнои и внутрисосудистои методик, сделало возможным пространственную реконструкцию ультразвукового изображения.
По совокупности данных, получаемых при обычных врачебных методах исследования больных и при использовании инструментальных методов, можно достичь весьма точной диагностики большинства пороков сердца и принять решение о возможности оперативного лечения.
Открытый артериальный (боталлов) проток
Порок характеризуется сохранением соустья между аортой и лёгочным стволом, существующего во время внутриутробного периода развития плода. Вскоре после рождения проток обычно облитериру-ется и превращается в артериальную связку. Функционирование артериального протока в течение первого года жизни считают врождённым пороком. Эту аномалию развития встречают наиболее часто, она составляет до 25% всех врождённых пороков.
Гемодинамическая сущность порока
Гемодинамическая сущность порока состоит в постоянном сбросе артериальной крови в малый круг кровообращения, вследствие чего происходит перемешивание артериальной и венозной крови в лёгких и развивается гиперволемия малого круга, сопровождающаяся постепенным возникновением необратимых морфологических изменений сосудов лёгких и последующим возникновением лёгочной гипер-тензии. При этом левый желудочек вынужден работать интенсивнее для поддержания устойчивой гемодинамики, что приводит к гипертрофии левых отделов сердца. Прогрессирующее повышение сопротивления сосудов малого круга вызывает перегрузку правого желудочка сердца, обусловливая его гипертрофию и последующую дистрофию миокарда. Степень нарушения кровообращения зависит от диаметра протока и объёма сбрасываемой через него крови.
Клиническая картина и диагностика
Характер клинических проявлений зависит, прежде всего, от диаметра и протяжённости протока, угла его отхождения от аорты и формы, что определяет величину сброса крови в лёгочную артерию. Жалобы обычно появляются с развитием декомпенсации кровообращения и заключаются в быстрой утомляемости и одышке. Для порока характерны частые респираторные заболевания и пневмонии на первом и втором годах жизни ребёнка, отставание его в физическом развитии. При обследовании больного обнаруживают систоло-ди-астолический шум над сердцем с эпицентром над лёгочной артерией. Характер шума часто сравнивают с «шумом волчка», «шумом мельничного колеса», «машинным шумом», «шумом поезда, проезжающего через тоннель». С развитием лёгочной гипертензии в этой же точке появляется акцент II тона. Как правило, шум становится интенсивнее при выдохе или физической нагрузке. Электрокардиографические признаки нехарактерны. При рентгенологическом исследовании определяют признаки переполнения кровью малого круга кровообращения и умеренно выраженную митральную конфигурацию сердца за счёт выбухания дуги лёгочной артерии. Отмечают гипертрофию левого желудочка. В поздние сроки естественного течения порока становятся более выраженными рентгенологические признаки склерозирования сосудов лёгких и обеднение их рисунка. Эхо-кардиография иногда позволяет визуализировать функционирующий открытый артериальный проток (обычно у маленьких детей). У взрослых пациентов этому мешает ограничение «ультразвукового окна» вследствие прилегания левого лёгкого. Катетеризация камер сердца необходима лишь в осложнённых или неясных случаях. При введении контрастного вещества в восходящую аорту оно через проток попадает в лёгочные артерии. В целом диагностика этого порока больших трудностей не представляет.
Частым осложнением открытого артериального протока (особенно малого диаметра) бывает воспаление стенок протока (боталлинит) или, в более старшем возрасте, его обызвествление.
Лечение
Спонтанное закрытие артериального протока наблюдают довольно редко. Как правило, оно происходит вследствие боталли-нита. Поэтому в настоящее время во всех случаях такого порока считают показаным оперативное лечение. Из левосторонней заднебоковой торако-
томии перевязывают проток двумя-тремя лигатурами, клипируют (рис. 29-1) или пе
ресекают его с последующим прошиванием и перевязкой обеих культей. В пос
леднее время развивается транскатетерная эмболизация открытого артериального протока при помощи специальных конструкций — окклюдеров. Суть метода заключается в доставке окклюдера при помощи Ние открытого артериаль-специальных зондов к функционирую- ного протока, щему артериальному протоку и установке конструкции в просвете боталлова протока таким образом, чтобы он перекрывал сообщение между аортой и лёгочной артерией.

|
Рис. 29-1 Клипирование открытого артериального протока
Прогноз
Наилучших результатов хирургического вмешательства достигают после операций в возрасте до 5 лет. В более старшем возрасте после перевязки открытого артериального протока сохраняется остаточная лёгочная гипертензия в результате необратимых морфологических изменений лёгких. Кроме того, операция у взрослых более опасна из-за возможного кровотечения вследствие прорезывания склерозированной или кальцинированной стенки протока лигатурой.
Дефект межпредсердной перегородки
Дефект межпредсердной перегородки — патологическое соустье между правым и левым предсердиями. Он составляет около 20% всех врождённых пороков сердца. Дефект может располагаться в различных отделах перегородки, иметь разнообразные форму и размеры. Условно различают первичные и вторичные (высокие) дефекты межпредсердной перегородки (рис. 29-2). Первичный дефект возникает вследствие недоразвития в эмбриогенезе первичной перегородки. Его отличительная особенность — локализация на уровне фиброзного кольца атриовентрикулярных клапанов, они становятся нижней стенкой такого дефекта. Порок иногда сочетается с расщеплением мит рального и трикуспидального клапанов, являясь компонентом так называемого открытого атриовентрикулярного канала. Вторичный дефект формируется вследствие нарушений эмбриогенеза вторичной перегородки. Нижний край такого дефекта составляет межпредсерд-ная перегородка.
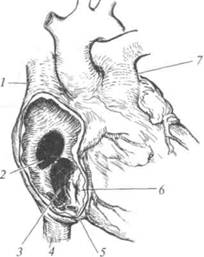
|
Рис. 29-2. Схема локализации дефектов межпредсердной перегородки: 7 — верхняя полая вена; 2— вторичный дефект межпредсердной перегородки; 3 — первичный дефект межпредсердной перегородки; 4 — нижняя полая вена; 5— коронарный синус; 6 — трёхстворчатый клапан; 7 — лёгочный ствол.
Гемодинамическая сущность порока
Гемодинамическая сущность порока заключается в сбросе артериальной крови из левого предсердия в правое, что вызывает гипер-волемию малого круга кровообращения, а в дальнейшем — развитие лёгочной гипертензии. Лёгочная гипертензия при дефекте межпредсердной перегородки носит весьма злокачественный характер, так как необратимые изменения в лёгких развиваются быстро, приводя к тяжёлой декомпенсации правых отделов сердца. Частым осложнением такого порока становится септический эндокардит.
Клиническая картина и диагностика
Обычно жалобы больных связаны с декомпенсацией кровообращения. Тяжесть её зависит от выраженности перегрузки правых отделов и развития лёгочной гипертензии. Больных беспокоят быстрая утомляемость и одышка, они подвержены простудным заболеваниям, особенно в раннем детском возрасте. Аускулыпативно дефект межпредсердной перегородки проявляется нежным систолическим шумом с эпицентром над лёгочной артерией. Шум обусловлен относительным стенозом основания лёгочного ствола, через который протекает избыточный объём крови. И тон над лёгочной артерией усилен и часто расщеплён. На ЭКГ заметны признаки перегрузки правых отделов сердца с гипертрофией правого желудочка и предсердия. Весьма часто обнаруживают неполную или полную блокаду правой ножки пучка Хиса.
При рентгенологическом исследовании определяют увеличение размеров сердца за счёт правых предсердия, желудочка и ствола лёгочной артерии. Выявляют также повышенную пульсацию корней лёгких и усиление общего сосудистого рисунка лёгочной ткани.
С помощью эхокардиографического исследования можно визуализировать дефект межпредсердной перегородки (рис. 29-3), уточнить его характер (первичный или вторичный), оценить направление сброса крови через дефект.
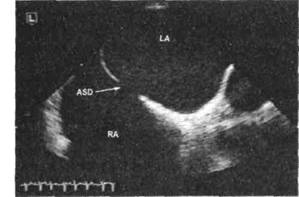
|
| Рис. 29-3. Эхокардиография в В-режиме больного с дефектом межпредсердной перегородки (ASD) (LA — левое предсердие, RA — правое предсердие). |
| При зондировании сердца обнаруживают повышение давления в правом предсердии, правом желудочке и лёгочном стволе. Зонд может переходить из правого предсердия в левое. Контрастное вещество, введённое в левое предсердие, через дефект межпредсердной перегородки попадает в правое предсердие и далее — в малый круг кровообращения. На основании рентгенологических данных можно рассчитать объём сброса крови, определить локализацию |
|
и размеры дефекта. Продолжительность жизни при дефекте межпредсердной перегородки без операции в среднем составляет около 25 лет.
Лечение
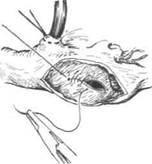
| Рис. 29-4.Ушивание дефекта межпредсердной перегородки в условиях искусственного кровообращения. Дефект щелевидной формы ушивают непрерывным обвивным двухрядным швом. |
|
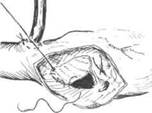
| Рис. 29-5.Пластика большого дефекта межпредсердной перегородки синтетической заплатой. |
Лечение только оперативное. Преимущественно выполняют операции на открытом сердце в условиях искусственного кровообращения или гипотермии (общей или краниоцеребральной). Вторичные дефекты средней величины можно ушить (рис. 29-4). Большие вторичные и все первичные дефекты, как правило, закрывают с использованием заплаты из ауто- или ксеноперикарда либо синтетических тканей (рис. 29-5). В последнее десятилетие развивается методика транскатетерного закрытия дефекта межпредсердной перегородки при помощи «пуговичных устройств». Суть метода заключается в доставке и установке в область дефекта под рентгеновским контролем специальными инструментами-зондами двух конструкций-дисков, напоминающих пуговицы. Причём одну из конструкций (так называемый контр-окклюдер) устанавливают со стороны правого, а другую (окклюдер) — со стороны левого
предсердия. Конструкции соединяют между собой в области дефекта при помощи специальной нейлоновой петли, вследствие чего они перекрывают сообщение между предсердиями.
Прогноз
Хорошие результаты операции могут быть получены лишь при её выполнении в раннем детском возрасте. Проведение операции в более поздние сроки не позволяет добиться всесторонней реабилитации пациентов вследствие формирования вторичных морфологических изменений в лёгких, миокарде и печени. Более того, развитие тяжёлой лёгочной гипертензии со сбросом справа налево — противопоказание к оперативному лечению.
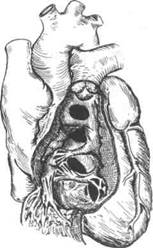
Дефект межжелудочковой перегородки
Дефекты межжелудочковой перегородки могут располагаться в её мембранозной или мышечной части (рис. 29-6), иногда выявляют полное отсутствие перегородки между желудочками.
Гемодинамическая сущность порока
Гемодинамическая сущность порока состоит в сбросе в фазу систолы артериальной крови из левого желудочка в правый, вследствие чего в систему малого круга попадает избыточный объём крови, что приводит к развитию гиперволемии сосудов лёгких с возникновением в последующем склеротической гипертензии. Прогрессирование гипертензии зависит главным образом от величины дефекта в перегородке, но необратимые изменения в лёгких могут развиться довольно быстро и обусловить функциональную неопе-рабельность больного, несмотря на отсутствие субъективных ощущений.
Клиническая картина
Клиническая картина у больных с дефектом межжелудочковой перегородки разнообразна и определяется главным образом размерами соустья и величиной сброса артериальной крови в систему малого круга. Наиболее частые жалобы — быстрая утомляемость, одышка, боли в области сердца и ощущение перебоев в его работе. В большинстве случаев происходит отставание ребёнка в физическом развитии. С прогрессированием лёгочной гипертензии давление в лёгочной артерии становится выше, чем в аорте, и изменяется направление шунта: венозная кровь смешивается с артериальной уже в левом желудочке, у больных появляется цианоз. Но, как правило, они редко доживают до этой (терминальной) стадии порока, так как развивается декомпенсация правого желудочка или естественное течение порока обрывается присоединяющимся инфекционным эндокардитом. Средняя продолжительность жизни детей с дефектом межжелудочковой перегородки без операции составляет около 15 лет.
|
Рис29-6. Схема локализации основных типовдефектов межкишечной перегородки (сверху вниз): надгребешковый, подгребешковый, канальный и мышечный типы.
Диагностика
Диагностика порока не представляет трудностей. Дефект межжелудочковой перегородки проявляется довольно интенсивным грубым систолическим шумом с эпицентром, соответствующим проекции отверстия в перегородке на передней грудной стенке. Как правило, это левый край тела грудины. Часто отмечают распространение шума вправо соответственно направлению струи крови, проходящей через дефект межжелудочковой перегородки. При гипертензии малого круга возникает акцент II тона над лёгочной артерией. ЭКГ указывает на комбинированную перегрузку желудочков с преобладанием перегрузки левого желудочка. Рентгенологическое исследование органов грудной клетки выявляет увеличение сердца за счёт правого желудочка, правого предсердия, выбухания лёгочного ствола. Лёгочный сосудистый рисунок обычно значительно усилен, а корни подчёркнуты и могут пульсировать. Вместе с тем, эти рентгенологические признаки нельзя считать патогномоничными. При неопределённости аускультативной картины необходимы катетеризация камер сердца, измерение давления в его полостях и сосудах, а также киноангиокардиография. Дефект межжелудочковой перегородки можно визуализировать с помощью эхокардиографии.
Лечение
Лечение только оперативное, в условиях искусственного кровообращения. Дефект ушивают различными приёмами или закрывают с помощью каких-либо пластических материалов (рис. 29-7). Ушивание небольших дефектов межжелудочковой перегородки можно выполнить и без искусственного кровообращения — в условиях общей или краниоцеребральной гипотермии. При своевременном выполнении оперативного пособия результаты лечения, как правило, хорошие.
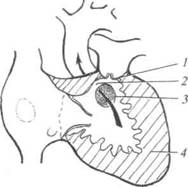
Тетрада Фалло
Это наиболее часто встречающийся порок синего типа. Его анатомическая сущность заключается в сочетании сужения выходного отдела правого желудочка, высокого дефекта межжелудочковой перегородки, смещения устья аорты вправо (декстрапозиция) и гипертрофии миокарда правого желудочка (рис. 29-8).
Гемодинамическая сущность порока
Основные нарушения гемодинамики при тетраде Фалло обусловлены тем, что венозная кровь из правого желудочка по время его систолы с трудом и в недостаточном количестве попадает в лёгочный ствол, вследствие чего возникает гиповолемия малого круга кровообращения. Большая часть венозной крови из правого желудочка через дефект межжелудочковой перегородки попадает в левый желудочек и аорту, смешиваясь с артериальной, что обусловливает цианоз кожных покровов.
Клиническая картина и диагностика
Тетрада Фалло сопровождается одышкой даже в состоянии покоя. Обращает на себя внимание цианоз кожных покровов и слизистых оболочек различной интенсивности. Пальцы рук деформированы в виде «барабанных палочек», ногти — в виде «часовых стёкол». Дети

|
Рис. 29-8. Тетрада Фало (схема): 1 —стеноз устья лёгочного ствола; 2 — дек-страпозиция аорты; 3 — высокий дефект межжелудочковой перегрородки; 4 — гипертрофия миокарда правого желудочка.
обычно значительно отстают в физическом развитии, часто болеют различными респираторными заболеваниями, ангинами и т.п. Грудная клетка, как правило, деформирована. После физической нагрузки возникают одышечно-цианотические приступы. Они бывают следствием хронической субпороговой ишемии мозга, проявляются одышкой, тахикардией, нередко с аритмией и усилением цианоза. Часто больные принимают положение на корточках, что облегчает их состояние, так как в этих условиях, по-видимому, увеличивается сопротивление в большом круге кровообращения, благодаря чему возрастает лёгочный кровоток.
Аускулътативно порок проявляется грубым пансистолическим шумом с максимумом звучания в четвёртом межреберье слева от грудины. II тон над лёгочной артерией ослаблен. На ЭКГ отмечают признаки значительной перегрузки и гипертрофии правого желудочка, а рентгенологически выявляют характерную конфигурацию сердца — западание лёгочной артерии с высоко приподнятой и закруглённой верхушкой сердца (в виде «голландского башмачка»), лёгочный рисунок значительно обеднён. В боковых позициях определяют выраженное увеличение правого желудочка. При зондировании катетер не удаётся провести в лёгочную артерию, и он легко проходит из правого желудочка в аорту. Контрастное вещество, введённое в правый желудочек, попадает и в лёгочную артерию, и в аорту, причём степень контрастирования этих сосудов зависит от величины транспозиции аорты.
Продолжительность жизни больных тетрадой Фалло без хирургического лечения определяется степенью кислородного голодания и в среднем составляет около 10—14 лет.
Лечение
Лечение только оперативное. Во время одышечно-цианотическо-го приступа больному следует придать коленно-локтевое положение, дать кислород, ввести тримеперидин и препараты, снижающие сопротивление малого круга кровообращения. Радикальную коррекцию порока выполняют в условиях искусственного кровообращения. Она заключается в расширении выходного отдела правого желудочка (т.е. в ликвидации препятствия оттока крови в малый круг) и закрытии дефекта межжелудочковой перегородки с перемещением аорты в левый желудочек. Операция сопровождается довольно высокой летальностью в ближайшем послеоперационном периоде. Однако у выживших, как правило, отдалённые результаты вполне оправдывают риск вмешательства. Если тяжесть состояния больных или анатомические особенности порока не позволяют выполнить его радикальную коррекцию, применяют паллиативные операции. Смысл их заключается в обогащении кровью малого круга кровообращения (создают соустье между аортой и лёгочной артерией или между полыми венами и лёгочной артерией). Участи больных, кроме сужения собственно выходного отдела правого желудочка, отмечают тяжёлое сужение лёгочного ствола и его артерий вплоть до гипоплазии. Этим больным можно выполнить только паллиативную операцию.
Коарктация аорты
Порок характеризуется врождённым сужением или полным закрытием просвета аорты на ограниченном участке. Чаще всего (95%) это сужение располагается в области перешейка аорты, под которым понимают отрезок от левой подключичной артерии до первой пары межрёберных артерий (рис. 29-9). Возможны и другие локализации сужений — в восходящей, нисходящей грудной или брюшной аорте. Коарктация аорты составляет до 30% всех врождённых пороков сердца.
Гемодинамическая сущность порока
Нарушения гемодинамики заключаются в затруднении тока крови через суженный участок, в результате чего значительно возрастает АД в аорте и её ветвях выше места сужения (до 200 мм рт.ст. и более). Развивается синдром артериальной гипертензии в сосудах головного мозга и верхней половины тела, что влечёт за собой систолическую
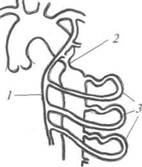
Рис. 29-9. Коарктация аорты (схема): 1 — левая внутренняя грудная артерия; 2 — зона сужения; 3 — расширенные межрёберные артерии.
перегрузку левого желудочка, гипертрофию миокарда с последующей его дистрофией. Последняя усугубляется присоединением со временем коронарной недостаточности. В итоге развивается тяжёлая декомпенсация левого желудочка. Гипер-тензия в системе сосудов мозга приводит к появлению церебральных симптомов. Ниже места сужения АД значительно снижено, и кровоснабжение нижней части тела осуществляется преимущественно за счёт коллатерального кровообращения, которое не всегда бывает достаточным.
Клиническая картина и диагностика
Жалобы, как правило, отсутствуют. Лишь с достижением возраста половой зрелости могут появиться общая слабость, головокружение, головные боли, парестезии и зябкость ног. Диагностика заболевания весьма простая: знание этой патологии и внимательное обследование позволяют точно поставить диагноз в подавляющем большинстве случаев. Отсутствие пульсации на артериях ног при постоянном повышенном давлении в артериях верхних конечностей — патогно-моничный признак коарктации аорты. При неполной окклюзии просвета аорты в области коарктации пульсация на артериях ног может сохраняться, но быть ослабленной, что подтверждается и сниженным АД (у здорового человека АД на нижних конечностях на 20-40 мм рт.ст. выше, чем на верхних). При осмотре, кроме соответствующей формы тела (нередко атлетический тип сложения у мужчин, пикнический — у женщин), можно заметить пульсацию расширенных межрёберных артерий. Границы сердца, как правило, расширены влево за счёт гипертрофии левого желудочка. При аускулыпа-ции слышен систолический шум по всему левому краю грудины, а также со стороны спины над проекцией сужения аорты, а иногда и над расширенными, пульсирующими межрёберными артериями. ЭКГ-данные у детей могут выявить лишь признаки систолической перегрузки левого желудочка, у взрослых — его гипертрофию и коронарную недостаточность, нередко с диффузными изменениями миокарда.
На рентгенограммах определяют преимущественно аортальную конфигурацию сердца за счёт расширения левого желудочка. Характерный признак коарктации аорты — наличие узур нижнего края 3— 4-х пар рёбер. Узурация рёбер развивается вследствие деформации кости в области нижней бороздки резко расширенными и извитыми межрёберными артериями. Как пульсацию межрёберных артерий, так и узурацию рёбер можно выявить при пальпации грудной клетки больного. На томограмме обычно хорошо видно место сужения аорты. Ангиокардиография показана в неясных случаях или при подозрении на сочетание коарктации аорты с другими пороками. Наиболее частые из них — открытый артериальный проток и стеноз устья аорты. В более поздние сроки может развиться недостаточность аортального клапана вследствие дистрофических изменений в основании восходящей аорты.
Средняя продолжительность жизни неоперированных больных 25-30 лет. Наиболее частая причина смерти — внутричерепные кровоизлияния, разрывы аорты, инфаркт миокарда, острая сердечная недостаточность и инфекционный эндокардит.
Дифференциальную диагностику коарктации аорты следует проводить с вегето-сосудистой дистонией, гипертонической болезнью, вазоренальной гипертонией, другими пороками сердца и заболеваниями почек, сопровождающимися артериальной гипертензией. Наибольшее количество ошибок в распознавании этого порока связано с забвением основных клинических проявлений заболевания, недооценкой общих врачебных методов исследования, пренебрежением к пальпации артерий конечностей, а также измерению АД на ногах и сравнительной оценкой полученных данных.
Лечение
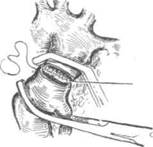
Лечение только оперативное. Идеальный вид операции, особенно у растущих детей, — резекция суженного участка аорты с её анастомозом по типу «конец в конец» (рис. 29-10). Однако такая операция нередко невыполнима при выраженной протяжённости сужения и тяжёлых склеротических изменениях стенки сосуда. В подобной ситуации проводят протезирование аорты синтетическим протезом, а также пластику места сужения синтетической заплатой (рис. 20-11) или левой подключичной артерией. Части пациентов можно выполнить баллонную дилатацию коарктации в условиях рентгеноперационной.
Прогноз
Результаты оперативного лечения в значительной степени зависят от возраста больного. Наилучшими они оказываются у детей, оперированных в возрасте до 3 лет, когда нет тяжёлых изменений стенки аорты и межрёберных артерий, а также имеются более благоприятные условия для радикальной коррекции порока, устранение которого обычно приводит к нормализации АД. Операция у взрослых значительно сложнее в техническом отношении и, как правило, даёт значительно менее выраженный гипотензивный эффект, так как в генезе артериальной гипертензии значительную роль играют изменения в центральной регуляции сосудистого тонуса и почечные механизмы формирования гипертензии. Вместе с тем, после устранения коарк-тации артериальная гипертензия становится «более управляемой» медикаментозными средствами, что позволяет предупредить развитие перечисленных выше тяжёлых осложнений. Через 1,5—3 года после коррекции порока артериальная
|
| Рис. 29-10. Наложение анастомоза «конец в конец» после резекции коаркта-ции аорты. |
 гипертензия становится менее выраженной. Таким образом, оперативное лечение коарктации аорты у взрослых в комплексе с антигипертензивной медикаментозной терапией в послеоперационном периоде позволяет значительно продлить жизнь больных и улучшить её качество.
гипертензия становится менее выраженной. Таким образом, оперативное лечение коарктации аорты у взрослых в комплексе с антигипертензивной медикаментозной терапией в послеоперационном периоде позволяет значительно продлить жизнь больных и улучшить её качество.
Рис29-11. Непрямая истмопластика грудной аорты синтетической заплатой.
 2018-01-08
2018-01-08 1399
1399








