К приобретённым относят группу пороков сердца, возникших как осложнение какого-либо заболевания или в результате травмы. Они характеризуются различными патологическими изменениями клапанного аппарата, приводящими к расстройству функций органа и всей системы кровообращения.
Чаще всего приобретённые пороки сердца формируются при ревматизме. Стенозирующие поражения клапанного аппарата почти в 100% случаев бывают результатом течения ревматического процесса. Вторая по частоте причина — инфекционный эндокардит, приводящий к разрушению створок клапанов и формированию их недостаточности. У 30—40% таких больных выявляют факторы, предрасполагающие к развитию септического поражения, — наличие предшествующих внутрисердечных патологических изменений (ревматический порок, опухоль, дефекты перегородок и др.).
Значительно реже пороки сердца могут формироваться за счёт ишемической болезни сердца (дисфункция сосочковых мышц иногда приводит к формированию недостаточности митрального клапана), дегенеративных изменений соединительной ткани (например, синдромы Марфана, Элерса—Данло и др.), атеросклероза (обызвествление фиброзного кольца аортального или, реже, митрального клапана с формированием его стенотического поражения), тупой травмы грудной клетки или ранения венечного сосуда.
_ Кроме органического поражения клапанов сердца, возможно формирование относительной недостаточности, обусловленной расширением фиброзного клапанного кольца в результате каких-либо заболеваний (миокардита, гипертонической болезни) или вследствие ге-модинамических нарушений, вызываемых пороками других клапанов.
Митральный стеноз
Порок характеризуется сужением левого атриовентрикулярного отверстия вследствие срастания между собой створок двустворчатого клапана, изменения подклапанных структур и фиброзной дегенерации клапанного кольца (рис. 30-1). Эти изменения создают препятствия току крови из левого предсердия в левый желудочек, что сопровождается уменьшением ударного и минутного объёмов кровообращения. Митральный стеноз ведёт к возникновению синдрома лёгочной гипертензии.
Основная причина возникновения митрального стеноза — ревматизм. Стенозирование левого атриовентрикулярного отверстия отмечают у 25% больных с заболеваниями сердца ревматического генеза. Приблизительно у 40% пациентов формируется комбинированный митральный порок — сочетание стеноза и недостаточности.
|
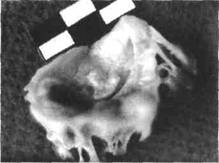
Рис. 30-1. Иссечённый митральный клапан. Створки резко фиб-розно изменены. Отверстие митрального клапана щелевидное. В толще створок — отложения солей кальция.
К сужению левого атриовентрикулярного отверстия могут также приводить опухоли (например, миксома), шаровидный тромб в полости левого предсердия, крупные вегетации при инфекционном эндокардите митрального клапана.
Классификация
Наиболее широкое распространение в России получила классификация митрального стеноза, предложенная А.Н. Бакулевым и Е.А. Дамир. Она включает пять стадий развития порока.
• I стадия — полная компенсация кровообращения. Больной не предъявляет никаких жалоб, но при объективном обследовании обнаруживают признаки, характерные для митрального стеноза. Площадь митрального отверстия составляет 3—4 см2, размер левого предсердия не более 4 см.
II стадия — относительная недостаточность кровообращения. Больной жалуется на одышку, возникающую при физической нагрузке, выявляют признаки гипертензии в малом круге кровообращения, несколько повышено венозное давление, однако выраженных признаков недостаточности кровообращения нет. Площадь митрального отверстия около 2 см2. Размер левого
• предсердия от 4 до 5 см.
• III стадия — начальная стадия выраженной недостаточности кровообращения. Появляются признаки застоя в малом и большом кругах кровообращения. Сердце увеличено в размерах. Венозное давление значительно повышено. Отмечают увеличение печени. Площадь митрального отверстия составляет 1—1,5 см2. Размер левого предсердия 5 см и более.
• IV стадия — резко выраженная недостаточность кровообращения со значительным застоем в большом круге. Сердце дилатировано, печень больших размеров, плотная. Отмечают высокое венозное давление, иногда небольшой асцит и периферические отёки. Для этой стадии характерно появление мерцательной аритмии. Терапевтическое лечение даёт временное улучшение. Митральное отверстие менее 1 см2, размер левого предсердия превышает 5 см.
• V стадия соответствует терминальной дистрофической стадии не
достаточности кровообращения по В.Х. Василенко и Н.Д. Стражеско. Отмечают выраженное увеличение размеров сердца, большую печень, резко повышенное венозное давление, асцит, значительные периферические отёки, постоянную одышку, даже в покое. Терапевтическое лечение не даёт эффекта. Площадь митрального отверстия менее 1 см2, размер левого предсердия более 5 см.
Клиническая картина
Основной жалобой больных митральным стенозом бывает одышка как следствие уменьшения минутного объёма кровообращения и нарушения механизма внешнего дыхания. Интенсивность её находится в прямой зависимости от степени сужения митрального отверстия. Сердцебиение — второй после одышки признак митрального стеноза, представляет собой проявление одного из компенсаторных механизмов, возникающих в ответ на недостаточность СВ. Кровохарканье и отёк лёгких встречают реже, они возникают главным образом при сочетании ревматического васкулита с выраженным застоем в лёгочных венах и бронхиальных сосудах. Реже кровохарканье связано с инфарктом лёгкого. Отёк лёгких обусловлен выраженной гипертен-зией малого круга кровообращения в сочетании с левожелудочко-вой недостаточностью. Возникающая при этом гипоксия приводит к повышению проницаемости сосудистой стенки и проникновению жидкой фракции крови в альвеолы. Кашель — частый признак митрального стеноза, он обычно связан с застойным бронхитом. Боли в области сердца — менее постоянный признак этого порока, они появляются лишь при значительном увеличении левого предсердия, сопровождающегося сдавлением левой венечной артерии. Общая физическая слабость весьма характерна для митрального стеноза, она бывает следствием хронической гипоксии организма, в частности скелетной мускулатуры.
Диагностика
В типичных случаях отмечают бледность кожных покровов с цианозом губ, щёк, кончика носа. Аускультативные данные весьма характерны: «хлопающий», «пушечный» I тон, акцент и раздвоение II тона над лёгочной артерией. Второй компонент этого тона регистрируется в виде «щелчка». Диастолический шум с пресистолическим усилением над верхушкой сердца — характерный аускультативный признак митрального стеноза, если сохраняется синусовый ритм. При тахикардии указанные аускультативные признаки могут отсутствовать. Поэтому при обследовании больного необходимо добиться уменьшения ЧСС (успокоить, придать больному горизонтальное положение, возможно, прибегнуть к медикаментозным средствам), после чего повторить аускультацию и фонокардиографию.
Рентгенологические признаки достаточно характерны: сердце митральной конфигурации с резким расширением лёгочной артерии и ушка левого предсердия, выраженный застой в сосудах лёгких смешанного характера, в тяжёлых случаях — признаки гемосидероза. На рентгенограмме в правой боковой проекции видно увеличение правого желудочка с заполнением ретростернального пространства. Кон-трастированный пищевод в этой проекции отклоняется по дуге малого радиуса (до 6 см), что свидетельствует об увеличении левого предсердия.
Характерные электрокардиографические признаки — отклонение электрической оси сердца вправо, признаки гипертрофии правого желудочка и левого предсердия, а также мерцательной аритмии в более поздние стадии заболевания. Фонокардиографические признаки, как правило, соответствуют данным аускультации. Весьма характерны эхокардиографические данные, позволяющие с большой точностью измерить митральное отверстие, составить представление о характере анатомических изменений клапана, распознать наличие тромбоза левого предсердия и оценить функциональное состояние сердца.
Лечение
Основной метод лечения больных с митральным стенозом хирургический. Оперативное лечение показано пациентам во II—IV стадиях заболевания. Больные в I стадии в операции не нуждаются. Пациентам с V стадией митрального стеноза хирургическое лечение абсолютно противопоказано, так как оно сопряжено с очень высоким риском и не улучшает состояния больных из-за выраженных органических изменений сосудов малого круга кровообращения, миокарда и печени.
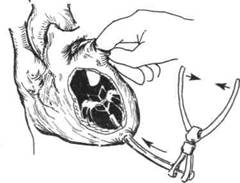
При митральном стенозе возможно выполнение как закрытых (т.е. без использования искусственного кровообращения), так и открытых (в условиях искусственного кровообращения) оперативных вмешательств. При неосложнённом митральном стенозе чаще всего выполняют закрытую митральную комиссуротомию. Операция заключается в пальцевом или инструментальном расширении левого венозного отверстия путём разделения сращений клапанных створок в области комиссур. Закрытая митральная комиссуротомия может быть выполнена из левосторонней или правосторонней торакотомии. При левостороннем доступе хирург вводит палец в левое предсердие через предсердное ушко и проводит ревизию митрального клапана. Комиссуротомию выполняют инструментом, проводимым в левый желудочек через прокол в верхушке сердца (рис. 30-2).
Рис. 30-2. Схема выполнения закрытой инструментальной митральной комиссуротомии из левостороннего доступа.
Выполняя вмешательство из правостороннего доступа, палец и инструмент подводят к митральному клапану через межпредсердную борозду. Правосторонний доступ обеспечивает более удобный переход к коррекции порока в условиях искусственного кровообращения. Это необходимо при обширном кальцинозе митрального клапана, наличии в левом предсердии тромба, неэффективности попыток закрытой комиссуротомии, а также при возникновении выраженной недостаточности клапана (II степень и более) после разделения ко-миссур или повреждения клапанных структур.
Выполнение открытой митральной комиссуротомии заключается в рассечении комиссур и подклапанных сращений стенозированно-го митрального клапана под контролем зрения в условиях искусственного кровообращения. При невозможности сохранения клапана (тяжёлые подклапанные сращения, массивный кальциноз, признаки активного инфекционного эндокардита), а также в случае возникновения недостаточности митрального клапана после предшествующих комиссуротомии выполняют его протезирование с использованием искусственных или биологических протезов.
Один из возможных методов коррекции митрального стеноза при его неосложнённом течении — чрескожная баллонная дилатация клапана. Суть метода заключается в подведении к левому венозному отверстию под рентгеновским и ультразвуковым контролем специального баллонного катетера и его расширении посредством резкого раздувания баллона. Это обеспечивает разделение створок клапана и ликвидацию стеноза. Инструмент к митральному клапану может быть доставлен через бедренную вену путём пункции межпредсердной перегородки или через бедренную артерию и левый желудочек.
Прогноз
Результаты оперативного лечения неосложнённого митрального стеноза в целом хорошие. Сразу же после операции больные отмечают уменьшение одышки, постепенно исчезают явления недостаточности кровообращения. Отдалённые результаты зависят от исходного состояния больных и стадии порока, в которой предпринято оперативное вмешательство. Они наилучшие, если операция выполнена во II—III стадии, когда вторичные изменения во внутренних органах, обусловленные недостаточностью кровообращения, носят обратимый характер. Подавляющее большинство таких больных возвращаются к своей прежней работе. Оперативное лечение в стадии тяжёлых расстройства кровообращения с необратимыми морфологическими изменениями внутренних органов (склеротическая фаза лёгочной гипертензии, тяжёлые дистрофические изменения миокарда, кардиальный цирроз печени и пр.) не позволяет добиться достаточно полной реабилитации пациентов и стабильности достигнутых результатов в отдалённые сроки.
Все больные, перенёсшие оперативное лечение, должны находиться под наблюдением ревматолога и получать сезонное противоревматическое лечение, так как сохраняется опасность развития митрального рестеноза или формирования недостаточности клапана, по поводу которых часто необходимо повторное оперативное вмешательство.
Недостаточность митрального клапана
Сущность порока состоит в нарушении замыкательной функции клапана вследствие фиброзной деформации створок, изменений под-клапанных структур, дилатации фиброзного кольца или нарушения целостности элементов митрального клапана (рис. 30-3), что обусловливает возврат части крови во время систолы из левого желудочка в предсердие (рис. 30-4). Эти нарушения внутрисердечной гемодинамики сопровождаются уменьшением минутного объёма кровообращения, развитием синдрома лёгочной гипертензии.
Митральная недостаточность иногда может возникнуть остро за счёт травмы фиброзного кольца, створок и подклапанных структур во время закрытой комиссуротомии; образования парапротезной фистулы вследствие прорезывания швов, фиксирующих искусственный клапан, или инфекционного эндокардита; ишемического повреждения папиллярных мышц, обусловленного инфарктом миокарда, и т.д.
|
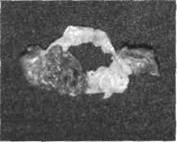
Рис. 30-3. Препарат митрального клапана, иссечённого во время операции. Створки разрушены с формированием недостаточности клапана, видны массивные вегетации.
Класификация
С целью градации недостаточности митрального клапана применяют классификацию, основанную на величине трансклапанной регургитации крови. Выделяют три степени митральной недостаточности.
• I степень — регургитация невыраженная, обратный ток крови в систолу желудочков определяют только у клапана.
• II степень — обратный ток крови определяют в середине левого предсердия, отмечают умеренное расширение предсердия.
• III степень — струя регургитации достигает задней стенки левого предсердия, предсердие значительно дилатировано.
|
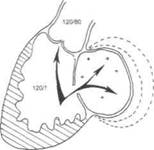
Рис 30-4. Схема гемодинамических нарушений при митральной недостаточности. В момент систолы желудочка часть крови через недостаточный митральный клапан возвращается в левое предсердие, вызывая его постепенную дилатацию.
Клиническая картина и диагностика
При митральной недостаточности в отличие от митрального стеноза одышка менее выражена и появляется в более поздние сроки формирования порока. Кровохарканье возникает редко, недостаточность кровообращения развивается значительно позже. На ЭКГ обычно отсутствуют признаки изолированной гипертрофии правого желудочка. Аускультативно и фонографически определяют систолический шум с эпицентром звучания над верхушкой сердца, распространяющийся в левую подмышечную область.
Клиническая симптоматика во многом связана со степенью нарушения кровообращения, зависящей главным образом от объёма регургитации крови из левого желудочка в предсердие, выраженности лёгочной гипертензии и состояния сократительной функции миокарда. С появлением тяжёлой недостаточности кровообращения медикаментозная терапия становится неэффективной вследствие необратимых изменений внутренних органов, прежде всего, сердца, возникающих в результате его хронической перегрузки и ревматического кардита.
Рентгенологически характерен застой в лёгких по венозному типу. При недостаточности митрального клапана левое предсердие отклоняет пищевод по дуге большого радиуса (более 7 см), преобладает увеличение левого желудочка над правым. Характерно систолическое увеличение (пульсация) тени левого предсердия, определяемое при рентгеноскопии.
В диагностике недостаточности митрального клапана существенную роль играет эхокардиография. Применение трансторакального и чреспищеводного сканирований позволяет определить характер патологических изменений клапана (инфекционный эндокардит, мик-соматозная дегенерация и т.д.), оценить выраженность нарушений внутрисердечной гемодинамики (степень регургитации, её характер). Данные эхокардиографического исследования вместе с клиническими проявлениями заболевания позволяют сформулировать показания к хирургическому лечению.
Оперативное лечение
Показанием к хирургическому лечению митральной недостаточности считают возникновение регургитации II—III степени. Хирургическую коррекцию порока проводят в условиях искусственного кровообращения, её задача — восстановление запирательной функции митрального клапана. Чаще всего этого достигают протезированием клапана (рис. 30-5) механическим или биологическим протезом. При ограниченных изменениях клапана могут быть выполнены клапаносохраняющие операции: шовная вальвулопластика или ану-лопластика, сужение фиброзного кольца специальным жёстким синтетическим кольцом, восстановление подклапанных структур, а также изолированное протезирование створок клапана ауто- или ксе-ноперикардом. Результаты хирургического лечения недостаточности митрального клапана в значительной степени зависят от своевременности определения показаний к оперативному лечению.
Аортальный стеноз
 Порок заключается в фиброзной деформации створок аортального клапана и срастании их между собой в области комиссур, что приводит к сужению искусственный клапан.
Порок заключается в фиброзной деформации створок аортального клапана и срастании их между собой в области комиссур, что приводит к сужению искусственный клапан.
Рис 30-5 Этап протезирования митрального клапана: после его иссечения наложены швы на фиброзное кольцо, фиксирующие искусственный клапан.

|
| Рис. 30-6. Иссечённый во время операции клапан у больного с аортальным стенозом. Видны обызвеств-лённые рыхлые вегетации. Створки резко обезображены, утолщены. |
устья аорты, затруднению и уменьшению выброса крови в неё левым желудочком (рис. 30-6). Естественное течение порока сопровождается хронической систолической перегрузкой левого желудочка с прогрессированием гипертрофии миокарда и его дистрофией, усугубляющей недостаточность кровообращения. Основной причиной возникновения стеноза клапана аорты бывает ревматизм, второй по частоте этиологический фактор — атеросклероз.
Клиническая картина
Клиническое течение аортального стеноза характеризуется наличием достаточно длительного скрытого периода, когда пациенты практически не предъявляют жалоб. Это обусловлено значительными компенсаторными возможностями левого желудочка. Основная жалоба больных — одышка, возникающая при физических нагрузках и нарастающая по мере прогресси-рования порока. За счёт снижения СВ и, как следствие, ухудшения кровоснабжения миокарда возникают боли в области сердца. В дальнейшем присоединяются головокружение, обмороки, нарушения ритма. Возможно развитие острой левожелудочковой недостаточности в виде «сердечной астмы», отёка лёгких.
Верхушечный толчок обычно хорошо виден. При пальпации у пациентов определяют систолическое дрожание. Аускулътативно аортальный стеноз проявляется грубым систолическим шумом с эпицентром звучания над устьем аорты, распространяющимся в правую подключичную область и на сосуды шеи. Электрокардиографические данные всегда свидетельствуют о гипертрофии и перегрузке левого желудочка, коронарной недостаточности (относительной или вследствие сопутствующего поражения венечных артерий). Для рентгенологической картины характерна аортальная конфигурация сердца за счёт увеличения левого желудочка и выраженной талии сердца. Нередко выявляют и постстенотическое расширение восходящей аорты. Эхокардиографическое исследование позволяет визуализировать морфологические изменения клапанного аппарата (характер стеноза, его выраженность, степень обызвествления створок), а также определить параметры гемодинамики, оценить миокардиальные резервы (рассчитать фракцию выброса, толщину стенок левого желудочка). При наличии стеноза клапана аорты перед оперативным вмешательством обязательно выполнение коронарографии, а также вентрикулог-рафии левого желудочка.
Лечение
Показания к хирургическому лечению аортального стеноза: появление одного или нескольких симптомов из характерной триады (обмороки, ангинозные боли, сердечная астма), выявление кардио-мегалии и выраженной перегрузки левого желудочка, наличие систолического трансвальвулярного градиента давления более 50 мм рт.ст. Оперативное лечение обычно заключается в протезировании клапана в условиях искусственного кровообращения.
Аортальная недостаточность
Сущность порока заключается в нарушении замыкательной функции аортального клапана в результате рубцовой деформации и укорочения створок, повреждения или расширения фиброзного кольца основания аорты, что приводит к возврату части крови в фазу диастолы из аорты в левый желудочек. При этом пороке наряду с уменьшением минутного объёма кровообращения возникает постоянная объёмная перегрузка левого желудочка в сочетании с коронарной недостаточностью. В отличие от аортального стеноза, при котором кровообращение длительно остаётся компенсированным за счёт гипертрофии левого желудочка, при аортальной недостаточности декомпенсация кровообращения, как правило, наступает довольно быстро в результате интенсивно прогрессирующей дистрофии миокарда.
Следует отметить особенности течения остро развившейся аортальной недостаточности. Полулунные клапаны аорты несут очень большую функциональную нагрузку. В случае острого разрушения створок из-за высокого диастолического градиента между восходящей аортой и левым желудочком возникает значительная регургитация крови в диастолу через несостоятельный клапан. При этом дилата-ция левого желудочка возникает очень быстро, компенсаторные механизмы включиться не успевают. В конце концов мощная объёмная (диастолическая) перегрузка приводит к истощению миокардиаль-ных резервов и развитию острой левожелудочковой недостаточности с последующим отёком лёгких и быстрым летальным исходом. Как правило, без хирургического лечения никто из пациентов с остро развившейся аортальной недостаточностью не живёт более 1 года от начала заболевания.
Наиболее частые жалобы на сердцебиение, одышку. В дальнейшем присоединяются боли в области сердца. Возможны неприятные ощущения усиленной пульсации сосудов шеи и конечностей, а также головокружение, обмороки.
При осмотре заметны бледность кожных покровов, синхронное с пульсацией сонных артерий сотрясение головы (симптом де Мюс-си), усиленная пульсация сонных артерий («пляска каротид»). Аус-культативно недостаточность аортального клапана проявляется преимущественно диастолическим шумом под устьем аорты и на верхушке сердца, а также ослаблением II тона над аортой. При выслушивании периферических сосудов (бедренной артерии) могут определяться двойной тон Траубе и двойной шум Дюрозье. Характерным клиническим признаком гемодинамически значимой аортальной недостаточности служит увеличение пульсового АД за счёт выраженного уменьшения диастолического и умеренного повышения систолического давления. Диастолическое АД при этом может снижаться до нуля, что свидетельствует о тяжёлой недостаточности аортального клапана. Электрокардиографическая картина характеризуется выраженной гипертрофией левого желудочка с явлениями нарушения трофики миокарда. Рентгенологические данные дают представление об аортальной конфигурации сердца, а также нередко свидетельствуют о застое в малом круге кровообращения. Эхокардиографическое исследование: гипертрофия миокарда, дилатация левого желудочка, расширение аорты. Возможна визуализация морфологических изменений клапана (вегетации, перфорации, разрыв, пролабирование), а также определение степени регургитации.
Лечение
Основной метод хирургического лечения пороков клапана аорты — протезирование. В настоящее время широко используют как механические, так и биологические протезы. В последнем случае применяют каркасные или бескаркасные модели (ксеноаортальные кондуиты). Биологические клапаны наиболее часто имплантируют пациентам пожилого возраста, так как их гемодинамические свойства несколько лучше. Кроме того, у этой категории больных они в меньшей степени подвергаются обызвествлению и дегенеративным изменениям, при имплантации таких протезов не требуется проведения пожизненной антикоагулянтной терапии. В ряде случаев, особенно у детей, возможно изолированное протезирование отдельных створок аортального клапана ауто- или ксеноперикардом.
Коррекцию пороков аортального клапана осуществляют в условиях искусственного кровообращения, холодовой и фармакологической кардиоплегии.
Прогноз
Результаты оперативного лечения зависят от сроков вмешательства, наилучшими они бывают в случаях выполнения вмешательства до развития тяжёлых дистрофических изменений миокарда и других органов. В случае протезирования клапанов сердца искусственными протезами больные должны находиться под наблюдением кардиолога. Таким пациентам показана профилактика инфекционного эндокардита, включающая мероприятия, уменьшающие возможность контаминации инфекции, а также превентивный приём антибактериальных препаратов широкого спектра действия при возникновении потенциально опасных состояний и манипуляций (острые респираторные инфекции, инвазивные стоматологические и эндоскопические манипуляции и др.).
Всем больным, перенёсшим протезирование клапана сердца искусственным протезом, пожизненно назначают приём антикоагулянтов (варфарин), дозировку которых подбирают, ориентируясь на показатели свёртывающей системы крови (так называемое международное нормализованное отношение, характеризующее уровень протромбина в крови, необходимо поддерживать в пределах 2,0-2,6).
Пороки трёхстворчатого клапана
Длительное время считали, что пороки трёхстворчатого клапана — большая редкость. Между тем, по данным ряда исследователей, они составляют до 25% всех приобретённых пороков сердца.
Клиническая картина и диагностика
Больные предъявляют жалобы на одышку при физической нагрузке, боли в области сердца. Наиболее типичным симптомом служит ощущение тяжести в правом подреберье вследствие повышенного кровенаполнения и увеличения печени. При осмотре отмечают расширение и пульсацию шейных вен. Выявление аускультативной симптоматики затруднено из-за невыраженности звуковых феноменов. Вместе с тем, при тщательном выслушивании у основания мечевидного отростка определяют диастолический шум при стенозе, систолический шум — при недостаточности трёхстворчатого клапана. Интенсивность шумов часто связана с дыханием — усиливается на вдохе. Для электрокардиографической картины характерны гипертрофия и перегрузка правых камер сердца. При рентгенологическом исследовании выявляют увеличение правых отделов, уменьшение нижнего отдела ретрокардиального пространства, выбухание лёгочной артерии. Ценный метод исследования — эхокардиография, позволяющая оценить как морфологические изменения трёхстворчатого клапана, так и нарушения гемодинамики в правых отделах сердца.
Оперативное лечение
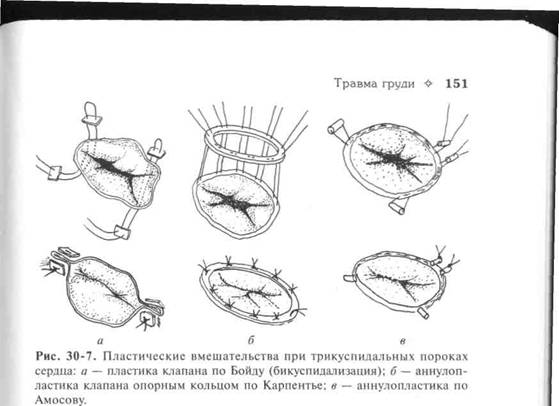
Особенности анатомического строения трикуспидального клапана позволили разработать широкий спектр оперативных вмешательств на нём. Они включают как различные пластические и клапа-носохраняющие операции (рис. 30-7), так и замену клапана искусственным протезом. Показания к протезированию клапана — резкая деформация створок клапана, массивные разрушения, не позволяющие выполнить клапаносохраняющую коррекцию, неэффективная аннулопластика, значительная дилатация правого желудочка.
Учитывая низкую скорость кровотока в правых отделах сердца, при протезировании трикуспидального клапана особенно важно пожизненное проведение антикоагулянтной терапии. Погрешности в приёме непрямых коагулянтов могут повлечь тромбоз искусственного протеза.
Проблема инфекционного эндокардита
Последние десятилетия характеризуются возрастанием частоты инфекционного эндокардита. Заболеваемость увеличивается при ухудшении социально-бытовых условий жизни. По данным эпиде-
миологических исследований, септический эндокардит встречают в 17-25 случаях на 1 млн жителей в год. Протезирование клапанов сердца, открыв новую эру в лечении больных врождёнными и приобретёнными пороками сердца, вместе с тем привело к возникновению различных осложнений, наиболее опасное из них — инфекционный эндокардит клапанных протезов. Даже в лучших кардиохирургичес-ких клиниках это осложнение возникает в 1-4% случаев.
Для развития заболевания необходимы исходное повреждение эндокарда, бактериемия и снижение иммунологической резистентности организма.
Повреждение эндокарда может быть вызвано следующими факторами:
• длительным нахождением катетера в центральной вене;
• струёй регургитации крови при врождённых пороках сердца;
• ревматическим поражением эндокарда;
• внутривенным применением наркотических средств (введением взвеси инородных частиц);
• циркуляцией в кровотоке микробных токсинов и вирусов.
Если на изменённый эндокард попадают микроорганизмы, инфекционный эндокардит развивается с большой долей вероятности.
Причинами бактериемии могут быть эндогенные инфекционные очаги (хронический периодонтит, тонзиллит, гайморит, фурункулёз, дис-бактериоз кишечника и др.), госпитальная инфекция (нагноение ран, катетерный сепсис, использование нестерильных растворов), острые респираторные заболевания. Бактериемия может возникать и у совершенно здоровых людей (например, после чистки зубов, постановки клизмы), но различные операции и инвазивные лечебные процедуры в значительной степени увеличивают её частоту и интенсивность. Катетеры в центральных венах инфицируются приблизительно в 10% наблюдений, причиной сепсиса они становятся приблизительно в 2,5 % случаев.
Важную роль в развитии инфекционного эндокардита играет состояние иммунной системы организма. Её ослабление в результате переохлаждения, плохого питания, стрессов может способствовать развитию инфекционного эндокардита.
Диагностика
Диагностика инфекционного эндокардита, особенно на ранних этапах развития заболевания, крайне сложна. Именно поэтому ранние стадии заболевания, когда возможен хороший эффект консервативной терапии или выполнение клапаносохраняющих операций, чаще всего бывают упущенными. Вот почему у 40% больных поражение сердца инфекционным процессом остаётся длительное время нераспознанным или не диагностируется вообще.
Основные клинические проявления инфекционного эндокардита включают три группы симптомов.
• Проявления инфекционно-септической интоксикации: лихорадка, озноб, слабость, потливость, артромиалгии.
• Нарушение гемодинамики вследствие поражения клапанного аппарата и миокарда.
• Специфические осложнения: тромбоэмболии, гломерулонефрит, васкулит.
За последние десятилетия клиническая картина инфекционного эндокардита существенно изменилась. У части пациентов классические симптомы могут отсутствовать. В последние десятилетия всё большее значение приобретают новые (неклассические) формы этого заболевания. К ним можно отнести инфекционный эндокардит правых камер сердца нозокомиальной природы (катетерный, после имплантации электрокардиостимуляторов, при системном гемодиализе и др.) или возникающий у наркоманов, инфекционный эндокардит клапанных протезов, абсцессы сердца.
Диагностика инфекционного эндокардита основывается на подтверждении инфекционной природы заболевания и верификации внутрисердечных поражений. Бактериологическая верификация заболевания очень важна, поэтому необходимо соблюдать следующие правила исследования больных с подозрением на это заболевание.
• Обязательный посев артериальной и венозной крови.
• Забор крови осуществляют до начала активной антибактериальной терапии.
• Количество посевов — от 3 до 7 раз и отдельно на высоте лихорадки и озноба.
• Использование умеренной физической нагрузки при отсутствии противопоказаний (переход из положения лёжа в положение сидя 3—5 раз) перед забором крови.
• Бактериологическое исследование операционного материала.
Такой подход позволяет получить положительные результаты исследования гемокультуры у 85% больных инфекционным эндокардитом.
Из инструментальных методов диагностики наибольшее значение на современном этапе получила эхокардиография. С её помощью можно изучить состояние морфологических структур сердца, что значительно улучшило выявление основных признаков инфекционного эндокардита: вегетации и внутрисердечных абсцессов. В настоящее время возможности метода расширились за счёт чреспищеводнои и внутрисердечной эхокардиографии.
Хирургическое лечение
Несмотря на успехи консервативного лечения хирургических инфекций, в последние годы при ряде форм септического эндокардита летальность достигает 80 и даже 100%. Это обусловлено изменениями структуры заболевания. Современное его лечение немыслимо без хирургического вмешательства. Основная тенденция — раннее хирургическое вмешательство на сердце до развития тяжёлых осложнений. Показания к хирургическому лечению инфекционного эндокардита следующие.
• Острое разрушение клапанов сердца.
• Артериальные тромбоэмболии (их опасность или рецидивирование).
• Признаки формирования абсцесса сердца.
• Грибковый эндокардит.
• Инфекционный эндокардит клапанного протеза (в том числе возникновение гемодинамически значимой параклапанной недостаточности).
• Внутрисердечные и внутрисосудистые очаги инфекции вследствие ранений сердца и крупных сосудов.
• Неэффективность этиотропной антибактериальной терапии в течение 3 нед.
Во время операции хирург должен провести санацию камер сердца и коррекцию нарушений внутрисердечной гемодинамики. Различают механические, химические и физические методы санации.
• Механическая санация заключается в максимально возможном удалении вегетации, иссечении поражённых и разрушенных инфекционным процессом внутрисердечных структур и образований (клапанов, вегетации пристеночного эндокардита, инфицированных тромбов и кальциевых конгломератов, абсцессов и т.д.).
• Химическая санация предполагает обработку камер сердца антисептиками.
• Физическая санация осуществляется путём обработки недоступных
иссечению тканей низкочастотным ультразвуком.
В каждом конкретном случае техника и объём санации камер сердца индивидуальны. Однако общим при её выполнении должно быть стремление к максимальной радикальности.
Наиболее частым вариантом коррекции нарушений внутрисердечной гемодинамики остаётся операция протезирования клапанов. К её особенностям относят необходимость тщательного иссечения инфицированных и разрушенных тканей, а также оставление тканей, из которых затем будет сформирована опора для клапанного протеза. Функционально более выгодным для больного вариантом служит клапаносохраняющая операция. Пластические вмешательства чаще возможны при поражении трёхстворчатого клапана. В среднем такие операции возможны у 10% больных.
Профилактика рецидива инфекционного эндокардита
Профилактику можно разделить на раннюю и отдалённую. К ранней профилактике относят особенности техники оперативного вмешательства, заключающиеся в щадящем отношении к тканям, низкой травматичности операции, тщательной санации камер сердца, использовании серебра и антибиотиков в оплётке протеза. Большое значение имеет своевременная и адекватная коррекция сердечной и дыхательной недостаточности, анемии, гипопротеинемии. Профилактика и своевременное лечение нагноения операционной раны и других гнойных осложнений, применение антибиотиков в адекватных дозах и соблюдение необходимой продолжительности их использования также играют важную роль в предупреждении инфекционного эндокардита после операций на сердце.
Пациентов, перенёсших инфекционный эндокардит и, тем более, оперативное лечение по поводу этого заболевания, относят к группе риска по развитию рецидива. В связи с этим в отдалённые сроки необходимо проводить профилактику рецидива заболевания при различных инвазивных процедурах, вызывающих бактериемию (стоматологические процедуры, эндоскопия и др.).
Глава 31 ПЕРИКАРДИТЫ
Перикардит — воспаление серозных оболочек околосердечной сумки, характеризующееся появлением экссудата в её полости с возможным образованием сращений и их Рубцовым перерождением.
Основные черты патологии
В норме в полости перикарда, выстланной изнутри мезотелием, всегда есть незначительное количество жидкости (не более 30 мл). Развитие перикардита вследствие воздействия повреждающего серозную оболочку фактора (возбудителя инфекции, аллергена, токсических метаболитов и пр.) нарушает обычное функционирование околосердечной сумки и внутриперикардиальную циркуляцию жидкости. Чрезмерное кровенаполнение (гиперемия) серозной оболочки и выпадение плазменного белка на её поверхности изменяют соотношение образования и резорбции перикардиальной жидкости. Экссудация значительно преобладает над всасыванием. В перикардиальной щели начинает скапливаться жидкость, содержащая фибрин и форменные элементы крови. Так возникает выпотной (экссудативный) перикардит.
При медленном накоплении экссудата в околосердечной сумке более интенсивно растягивается её левая боковая стенка. Если темп образования экссудата опережает перестройку перикарда и расширение его полости, жидкость скапливается больше справа от сердца и над диафрагмой. В такой ситуации может возникнуть острое состояние, приводящее к резкому падению насосной функции сердца, — так называемая тампонада сердца. При относительно небольшой скорости экссудации и незначительном количестве выпота, богатого фибриногеном, происходит выпадение фибрина на серозных листках, преимущественно на верхушке сердца и эпикарде. Возможно формирование целого пласта фибриноидной массы, окружающего сердце в виде капюшона. В последующем происходят организация экссудата, образование рубцовой ткани с частичным или полным сращением листков перикарда и облитерацией его полости — слип-чивый перикардит.
Значительная инфильтрация серозных оболочек (на всю глубину) приводит к рубцовым изменениям листков околосердечной сумки, что чревато иммобилизацией сердца вследствие сращения эпикарда и перикарда, превращающихся в единую сдавливающую оболочку — констриктивный перикардит.
Иногда в полости перикарда может скапливаться жидкость невоспалительного характера. При тяжёлых декомпенсированных заболеваниях сердца с выраженной недостаточностью кровообращения в полости перикарда, как и в других серозных полостях, накапливается транссудат — развивается гидроперикард. Патология лимфатической системы перикарда (лимфангиэктазии с нарушением целостности их стенок, реже — травмы грудного лимфатического протока) может привести к скоплению лимфы с развитием хилоперикарда. Инфицирование скопившегося содержимого вызывает развитие гнойного перикардита.
Патоморфология
Морфологические изменения перикарда зависят от остроты воспаления серозных оболочек, интенсивности и выраженности экссу-дативных и пролиферативных процессов. При умеренной интенсивности экссудации, сохранении всасывательной способности по отношению к воде, электролитам и мелкодисперсным белкам основные изменения перикарда и эпикарда проявляются гиперемией, набуханием и десквамацией мезотелия. Наложения фибрина умеренные, но по мере прогрессирования процесса их количество может возрастать. Тяжи фибрина располагаются между листками околосердечной сумки, соединяя их так, что при отделении перикарда от эпикарда сердце имеет вид «ворсинчатого» или «волосатого» (corvillosum).
Если интенсивность экссудации более значительна, в полости околосердечной сумки начинает накапливаться жидкий выпот, содержащий пласты слущенного мезотелия, клетки крови, хлопья фибрина. При гнойном перикардите наряду с клетками, клеточным детритом и хлопьями фибрина в выпоте обнаруживают различные микроорганизмы и простейших, патогенные грибы, гистоплазмы.
Организация выпота с последующим рубцеванием может завершиться обызвествлением и оссификацией рубцовой ткани (особенно часто при туберкулёзном перикардите). Очаги таких изменений могут располагаться не только в перикарде, но и в эпикарде в местах наибольшей выраженности воспалительной инфильтрации (венечная борозда, диафрагмальная поверхность сердца). Иногда они охватывают всё сердце, создавая как бы костный панцирь («панцирное сердце»), и могут распространяться до эндокарда. Толщина рубцово-из-вестковых образований в этих случаях может доходить до 1-2 см. Рубцово-изменённые и сросшиеся листки перикарда и эпикарда, пропитанные солями кальция, препятствуют нормальным сердечным сокращениям, ограничивая их амплитуду как в систолу, так и в диастолу. Постепенно развивается иммобилизация сердца, его насосная функция осуществляется только за счёт движений межжелудочковой перегородки.
Классификация
Характер перикардита:
• острый:
—экссудативный (выпотной);
—сухой (фибринозный);
• хронический:
—экссудативный;
—слипчивый;
—сдавливающий (констриктивный). Природа заболевания:
• инфекционный неспецифический:
—бактериальный (стафилококковый, стрептококковый, анаэробный, менингококковый, брюшнотифозный);
—вирусный;
—риккетсиозный;
—грибковый;
—протозойный;
• инфекционный специфический:
—туберкулёзный;
—сифилитический;
• инфекционно-аллергический, аллергический или аутоиммунный (ревматический, волчаночный, склеродермический, ревматоидный, лекарственный);
• токсический:
—уремический;
—подагрический;
—панкреатический и др.;
* опухолевый (при опухолях лёгкого, плевры, средостения, лимфогранулематозе);
• лучевой (при лучевой болезни, местной лучевой терапии);
• постинфарктный;
• посттравматический (после ранений сердца, перикарда и хирургических вмешательств).
Характер экссудата:
• серозный;
• серозно-фибринозный;
• гнойный;
• гнилостный;
• хилёзный.
Осложнения:
• тампонада сердца;
• недостаточность кровообращения.
Клиническая картина
Клиническая симптоматика острого перикардита обусловлена нарушениями гемодинамики, имеющими экстракардиальную (тампонада сердца) или миокардиальную (изменения самой сердечной мышцы) природу, раздражением нервных окончаний листков околосердечной сумки и общими проявлениями воспалительного процесса. Эти симптомы могут быть малозаметными на фоне основного заболевания, особенно если оно носит системный характер (ревматизм, коллагенозы, туберкулёз) либо когда перикардит возникает в связи с очагами инфекции, локализованными рядом с сердцем (ме-диастинит, эмпиема плевры, абсцессы в окружающих сердце органах) или в самом миокарде.
Для распространённого по серозным оболочкам фибринозного перикардита характерны давящие боли в области сердца постоянного характера, не купируемые нитратами. Интенсивность кардиалгии меняется при дыхательных движениях, поворотах туловища, но не зависит от физической нагрузки. Боли усиливаются при надавливании рукой или фонендоскопом на грудину больного. Иногда эти боли появляются при глотании, сопровождаясь разнообразными ощущениями, вплоть до дисфагии.
Второй кардинальный симптом фибринозного перикардита — шум трения перикарда, выявляемый у трёх четвертей больных этой формой заболевания. Он носит непостоянный характер, синхронизирован с сокращениями сердца и не исчезает при задержке дыхания. Шум локализован в зоне абсолютной сердечной тупости, плохо проводится за её пределы и так же, как и боль в прекардиальной области, может усиливаться при надавливании фонендоскопом на зону аускуль-тации. Если болевой синдром отсутствует, на первый план выступают симптомы интоксикации (слабость, недомогание, повышение температуры тела), а об изменениях перикарда свидетельствует шум трения перикарда в сочетании с данными специальных исследований.
Клиническая картина выпотного перикардита определяется выраженностью и распространённостью воспалительных изменений в перикарде, темпом накопления экссудата и его количеством, нарушением функций органов, окружающих сердце (лёгких, трахеи, пищевода), впадающих в сердце крупных сосудов, особенно полых вен. Для экссудативного перикардита характерны отставание в дыхании левой половины грудной клетки, выпячивание надчревной области, расширение подкожных вен шеи и верхней половины туловища. Даже при крайних степенях расширения яремных вен их пульсация отсутствует.
Стойкая, резистентная к проводимому лечению тахикардия сочетается с парадоксальным пульсом (снижение наполнения и даже полное исчезновение пульса на вдохе). Верхушечный толчок ослаблен, при большом объёме выпота в перикарде он определяется выше, чем обычно (в III—IV межреберье). Отмечают несоответствие между относительно удовлетворительным наполнением пульса и значительным ослаблением верхушечного толчка. Площадь сердечной тупости расширена как вправо (до среднеключичной линии), так и влево (до средней подмышечной линии). Сердечная тупость сливается с печёночной, а границы абсолютной и относительной тупости совпадают.
Тоны сердца умеренно ослаблены, отмечают снижение систолического АД при возрастании венозного давления (до 30—40 см вод.ст.), увеличиваются размеры печени, главным образом левой доли, появляются признаки асцита, обычно предшествующие появлению отёков нижних конечностей. При значительном выпоте в околосердечной сумке выявляют симптомы сдавления соседних органов: дисфагию, упорный кашель, одышку (возможен ателектаз нижней доли левого лёгкого). Одновременно отмечают укорочение лёгочного звука над левым лёгким с усилением голосового дрожания или бронхофонии в левой подлопаточной области, которое исчезает в коленно-локте-вом положении.
Тампонада сердца может произойти и при относительно небольшом объёме выпота (до 400 мл), когда перечисленные клинические признаки скопления жидкости в перикарде могут отсутствовать. В основе этого грозного осложнения перикардита лежит быстрое возрастание внутриперикардиального давления. Характерные признаки тампонады сердца — падение артериального и быстрое нарастание венозного давления. У таких больных наряду с давящими болями в области сердца появляется чувство страха смерти. Для облегчения своего состояния пациенты занимают вынужденное положение: сидя с наклоном туловища вперёд или полулёжа. Кожа бледная, покрыта холодным потом. Нарастает цианоз губ и лица, вены шеи расширены, но не пульсируют. Пульс малый, едва прощупывается, частый, носит парадоксальный характер, систолическое и пульсовое АД снижено. Печень увеличена, резко болезненна. Вследствие критического падения СВ возникают симптомы нарушения мозгового кровообращения, и лишь неотложные мероприятия по эвакуации выпота из полости перикарда позволяют спасти жизнь больного.
Наиболее характерные проявления слипчивого перикардита (без сдавления сердца) включают колющие или режущие боли в области сердца, возникающие при неловких движениях, сердцебиение с резкой лабильностью пульса и АД. При осмотре больного обращает внимание отсутствие признаков недостаточности кровообращения, а анамнестические данные свидетельствуют о перенесённом фибринозном или выпотном перикардите той или иной природы.
Сдавливающий перикардит возникает, когда доминирующий фиб-ропластический процесс в оболочках околосердечной сумки приводит к их резкому утолщению и сморщиванию. Иммобилизация сердца может возникать как на фоне продолжающегося воспалительного процесса, так и при развитии Рубцовых изменений и кальциноза. В отличие от слипчивого перикардита, протекающего без сдавления сердца и полых вен, при констриктивном перикардите клиническую картину определяют нарушения кровообращения в связи с иммобилизацией сердца. В основе этих нарушений лежит не просто сдавление сердца утолщённым и рубцово изменённым перикардом, а именно нарушение его подвижности за счёт сращений между изменённым эпикардом и склерозированным, нередко кальцинированным перикардом, что ограничивает как диастолу, так и систолу желудочков. Иммобилизация предсердий, сдавление устьев полых и печёночных вен играют в генезе нарушений кровообращения менее значимую роль.
В начальной стадии больные всегда однотипно реагируют на физическую нагрузку появлением одышки и тахикардии, снижением системного АД, но ортопноэ для них не характерно. Венозный застой характеризуется стойким набуханием шейных вен, одутловатостью лица, увеличением печени, повышением венозного давления. В развёрнутой стадии сдавливающего перикардита одышка носит постоянный характер, появляется пульсация яремных вен, выявляют стойкую венозную гипертензию до 30 см вод.ст. Отмечают тенденцию к системной артериальной гипотензии с сохранением обычного уровня диастолического давления. Тахикардия сменяется пароксизмами мерцательной аритмии с последующим переходом её в постоянную форму. Тоны сердца становятся лабильными, резко увеличивается печень, и появляется асцит, не возникающий так рано ни при каком другом варианте недостаточности кровообращения. В дальнейшем наряду с асцитом и выпотом в плевральных полостях возникают массивные периферические отёки, лимфостаз нижних конечностей, дистрофические изменения внутренних органов, гипопротеинемия. При прогрессировании гипопротеинемии и гипоальбуминемии (ниже 20 г/л) болезнь переходит в дистрофическую стадию.
Клиническое течение
Развитие фибринозного перикардита зависит от этиологических факторов и условий возникновения воспалительного процесса в оболочках околосердечной сумки. Особенно длительное течение свойственно туберкулёзному перикардиту, по ходу его развития возможны повторные обострения и периоды стихания воспаления, когда сохраняется лишь шум трения перикарда. При благоприятном течении асептического перикардита (при инфаркте миокарда, ревматизме) он иногда может закончиться полным выздоровлением в течение 1—2 нед, не оставив никаких следов, но чаще трансформируется в слипчивый перикардит.
Исчезновение ярких клинических проявлений заболевания может свидетельствовать не только о разрешении воспалительного процесса в околосердечной сумке, но и о накоплении в ней выпота. Течение выпотного перикардита всегда длительное (недели, месяцы), что определяется этиологией заболевания, выраженностью и глубиной воспалительных изменений. Лишь в лёгких случаях может произойти полное рассасывание выпота, но часто в результате его организации происходит сращение листков перикарда (частичное или полное) либо развивается сдавление сердца. Иногда возможно изменение характера выпота: при проникновении в перикардиальную полость гноеродной флоры серозно-фибринозный выпот превращается в гнойный. Чаще всего возникновение гнойного перикардита определяется поступлением инфекции извне (раневой, послеоперационный перикардит) либо из очагов, расположенных рядом с околосердечной сумкой (пневмония, пиопневмоторакс, гнойный медиастинит или перитонит, абсцессы печени и др.), либо из отдалённых регионов (гематогенным или лимфогенным путём) с развитием септического перикардита. У таких больных не только более выражены клинические проявления поражения перикарда и быстрота развития критического состояния, но и в значительно большей степени выражены признаки системной воспалительной реакции: лейкоцитоз, увеличение СОЭ, анемия и пр.
Диагностика
На ранних стадиях перикардита большое значение имеет сопоставление данных физикального обследования с анамнестическими сведениями. Упоминания о туберкулёзе, ревматизме, полисерозите при больших коллагенозах, травме области сердца или лучевой терапии в этой зоне позволяют обоснованно заподозрить воспаление околосердечной сумки.
Результаты лабораторных исследований крови позволяют конкретизировать остроту воспалительного процесса. Обязательно проведение серологических исследований, в том числе и с туберкулёзным антигеном.
Клиническое обследование и результаты простых инструментальных исследований (запись ЭКГ) предоставляют достаточно оснований для постановки диагноза. Электрокардиографические изменения характерны для субэпикардиальной ишемии в виде конкордантного смещения интервала S-T, изменения зубца Т (уплощённый или отрицательный). По мере накопления выпота наблюдают снижение вольтажа зубцов ЭКГ, выраженную электрическую альтернацию. Характерны для сдавливающего перикардита пароксизмальные нарушения ритма — мерцание или трепетание предсердий.
Рентгенологически при выпотном перикардите выявляют увеличение размеров сердечной тени в поперечнике, укорочение сосудистого пучка. Изменяется силуэт сердца: он становится симметричным, талия сглаживается, отмечают расширение границ вправо. Сердечная тень закруглена и напоминает кисет или напряжённый мешок, форма которого приближается к шаровидной. Пульсация контуров сердечной тени ослаблена. Применение эхокардиографии позволяет определить объём экссудата в околосердечной сумке. При этом выявляют симптом «плавающего сердца».
КТи МРТпе только позволяют выявить увеличение размеров тени сердца и наличие жидкости в полости перикарда, но также дают возможность уточнить характер содержимого полости (жидкость или фиброзная ткань), толщину и плотность сдавливающих оболочек.
Пункция перикарда с удалением выпота и последующим введением газа в его полость, а также рентгенологическое исследование на фоне пневмоперикарда позволяют оценить истинные размеры сердца, состояние серозных поверхностей, наличие фибринозных наложений.
Дифференциальная диагностика
Боли в области сердца при фибринозном перикардите, усиливающиеся при глотании и приводящие к боязни приёма пищи, могут послужить основанием для предположения о наличии кардиоспазма, грыжи пищеводного отверстия и даже новообразования пищевода. При большом объёме экссудата в полости перикарда необходимо проводить дифференциальную диагностику с декомпенсированными ревматическими много клапанными пороками, гипертрофической и дилатационной кардиомиопатией, диффузными миокардитами, ише-мической болезнью сердца с развитием постинфарктной аневризмы сердца.
Лечение
Консервативная медикаментозная терапия с использованием антибактериальных и противовоспалительных препаратов играет существенную роль при фибринозном и выпотном перикардитах с небольшим количеством экссудата. Тампонада сердца — показание к неотложной пункции полости перикарда, не только служащей основной мерой неотложной помощи таким больным, но и позволяющей уточнить этиологию заболевания. Пункцию целесообразно завершать дренированием полости перикарда для проведения локальной антибактериальной, фибринолитической и противовоспалительной терапии. При значительном скоплении гноя в околосердечной сумке,
признаках сепсиса показана экстраплевральная перикардиостомия с последующей санацией околосердечной сумки.
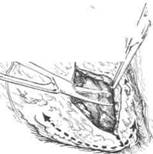
Рис31-1. Перикард острым путем отделяют от стенки сердца. Стрелками указаны направления разрезов перикарда или перикардэктомии.
Сдавливающий перикардит — прямое показание к хирургическому лечению (учитывая прогрессирование заболевания и бесперспективность консервативной терапии). Оперативное вмешательство предусматривает выполнение субтотальной перикардэктомии — последовательного освобождения левого желудочка, затем устья лёгочного ствола, аорты, правого желудочка и устьев полых вен от фиб-розно-кальциевой капсулы (рис. 31-1). Такая очерёдность предупреждает в период операции перегрузку правых отделов сердца и развитие отёка лёгких. Чаще всего подобное вмешательство выполняют путём продольного рассечения грудины либо торакотомии по пятому межреберью.
Показаниями к использованию искусственного кровообращения при перикардэктомии считают выраженный кальциноз перикарда, сопутствующий сдавливающий эпикардит и повторный характер операции. Операция в условиях искусственного кровообращения позволяет добиться максимального освобождения обоих желудочков сердца от сдавливающих оболочек с положительными гемодинамическим и клиническим эффектами. Искусственное кровообращение обеспечивает адекватную гемодинамику во время манипуляций на сердце и обширной резекции перикарда, в значительной степени снижая риск развития тяжёлых осложнений, а в случае их возникновения создаёт благоприятные условия для их ликвидации.
Ближайшие и отдалённые результаты оперативного лечения пациентов со сдавливающим перикардитом в подавляющем большинстве случаев хорошие.
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Хирургические вмешательства при ишемической болезни сердца (ИБС) в настоящее время получили повсеместное распространение и прочно вошли в арсенал средств лечения этого заболевания. Восстановление кровотока в миокарде осуществляют путём прямой операции на сердце с помощью аортокоронарного шунтирования либо используют непрямую (эндовазальную) баллонную дилатацию (ангиопластику) стенозированных венечных артерий. Таким образом, лечением ИБС сейчас занимаются не только терапевты, как это было принято на протяжении большей части прошлого XX столетия, но и кардиохирурги совместно с кардиологами. Такой подход открыл новые перспективы в решении проблемы самой распространённой сердечно-сосудистой патологии.
Основные черты патологии
В основе подавляющего большинства случаев ИБС и её осложнений лежит атеросклеротическое поражение (сужение или полная окклюзия) коронарных артерий, приводящее к значительному уменьшению кровоснабжения миокарда в определённой части сосудистого русла сердца. На первых этапах заболевания недостаточное кровоснабжение миокарда больной ощущает во время физической нагрузки, когда возникает типичный приступ стенокардии. По мере про-грессирования коронарного атеросклероза появляется стенокардия покоя. Если коронарный кровоток не восстанавливается, следующий закономерный этап — инфаркт миокарда, развитие которого чаще всего происходит вслед за формированием тромба в зоне атероскле-ротического сужения венечной артерии. В свою очередь инфаркт миокарда может стать причиной митральной недостаточности (за счёт поражения папиллярных мышц), дефекта межжелудочковой перегородки, внутрисердечного тромбоза и тромбоэмболии артерий большого круга кровообращения, аневризмы левого желудочка, которые сами по себе могут стать объектами хирургического вмешательства, так как реально угрожают жизни больного.
Поскольку атеросклероз — системное заболевание, следует помнить, что у одного и того же больного могут быть признаки ИБС, хронической артериальной недостаточности нижних конечностей (см. главу 35), нарушения кровоснабжения головного мозга и т.д.
Диагностика
В коронарной хирургии широко применяют весь арсенал диагностических методов, традиционно используемых в кардиологической практике (ЭКГ, в том числе в сочетании с физической нагрузкой и медикаментозными пробами, рентгенологические и радионуклид-ные методы, УЗИ). Катетеризация левых отделов сердца позволяет определять конечное диастолическое давление в левом желудочке — показатель, имеющий большое значение для оценки функциональных возможностей миокарда, особенно если это исследование сочетать с измерением СВ. Левая вентрикулография предоставляет возможность изучить движение стенок левого желудочка, а также рассчитать его систолический и диастолический объёмы, толщину стенок, оценить сократительную функцию, рассчитать фракцию выброса. Селективная коронарография предназначена для визуализации коронарных артерий и их основных ветвей, изучения анатомического и функционального состояния сосудистого русла, степени и характера поражения атеросклеротическим процессом, компенсаторного коллатерального кровообращения. В 95% случаев она точно и объективно отражает анатомическое состояние венечного русла.
Показания к рентгеноконтрастному исследованию коронарных артерий и левого желудочка следующие.
• Ишемия миокарда, выявленная с помощью неинвазивных методов диагностики.
• Наличие любого типа стенокардии, подтверждённого неинвазив-ными методами исследования (изменения на ЭКГ в покое, проба с дозированной физической нагрузкой, суточное ЭКГ-мониториро-вание).
• Инфаркт миокарда в анамнезе с последующей постинфарктной стенокардией.
• Инфаркт миокарда в острой фазе.
• Предоперационная оценка состояния коронарного русла у пациентов старше 40 лет с пороками клапанов сердца.
Принципы хирургического лечения
Выбор способа хирургической реваскуляризации миокарда при ИБС достаточно сложен. Баллонную ангиопластику обычно выполняют при гемодинамически значимом поражении коронарных артерий в их проксимальных отделах (кроме устьевых стенозов) в тех случаях, когда отсутствует выраженный кальциноз, а проходимости дистального сосудистого русла сохранена. Для уменьшения частоты рецидивов это вмешательство дополняют имплантацией в место стеноза специальных атромбогенных каркасных конструкций — стентов (рис. 32-1). В современной кардиохирургической практике это оперативное вмешательство выполняют в 2 раза чаще, чем прямую операцию на коронарных сосудах. Необходимое условие выполнения ангиопластики венечных артерий — наличие готовой операционной и хирургической бригады для выполнения прямой экстренной операции на сердце в случае появления осложнений.
Прямые оперативные вмешательства при ИБС предполагают выполнение шунтирующих операций, т.е. восстановление кровотока в обход стенозированного или окклюзированного участка венечных артерий. Чаще всего шунт (используют большую подкожную вену бедра или голени, внутреннюю грудную или лучевую артерии) накладывают между аортой и венечными артериями дистальнее зоны
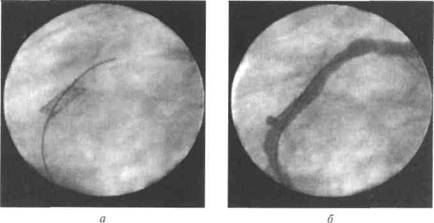
Рис. 32-1. Баллонная дилатация и стентирование коронарной артерии: а — видна тень стента, установленного в зоне стеноза после его дилатации; б — после эндоваскулярного вмешательства просвет сосуда восстановлен.
атеросклеротической окклюзии (стеноза), т.е. выполняют аортокоронарное шунтирование. Обычно хирургам приходится одновременно накладывать несколько шунтов (рис. 32-2).
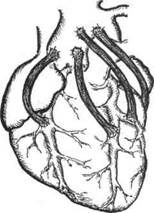
Рис.32-2. Шунтирование коронарных артерий аутовенозными трансплантантами.
В настоящее время при определении показаний к аортокоронарному шунтированию учитывают следующие моменты.
• Клиническая картина заболевания, т.е. выраженность стенокардии, её устойчивость к лекарственной терапии.<
 2018-01-08
2018-01-08 1006
1006








