Второй закон термодинамики. Энтропия. Второе начало термодинамики и живые организмы.
Второй закон термодинамики, или закон возрастания энтропии: различные виды энергии могут полностью превращаться в теплоту, но невозможно полное превращение в работу.
Второе начало термодинамики, сформулированное в 1850г Р.Клаузиусом: теплота не может самопроизвольно переходить от более холодного тела к более нагретому.
Энтропия- мера необратимости процесса в изолированных системах, или мера беспорядка в системе. В самопроизвольных системах энтропи стремится к максимуму.
В изолированных системах ΔS=0 при обратимых реакциях, ΔS>0 (возрастает) при необратимых.
7) Термодинамические факторы, определяющие направление химических реакций. Свободная энергия Гиббса.
Факторы, определяющие направление реакции: а)Тенденция к достижению минимума внутренней энергии; б)тенденция к достижению наиболее вероятного состояния.
Энергия Гиббса- функция состояния, изменение которой в обратимом изобарно-изотермическим процессе равно максимально полезной работе
ΔG=0 –состояние химического равновесия
ΔG0r>0 – эндергонические несамопроизвольные реакции
ΔG0r<0 – экзергонические самопроизвольные реакции
Объединенное выражение для первого и второго начал термодинамики: ΔG=ΔH-ТΔS
«Энергия Вселенной постоянна, а энтропия Вселенной стремится к максимуму»,-Клаузиус.
Задачи химической кинетики. Скорость химической реакции. Факторы, влияющие на скорость химических реакций.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.[
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Например для реакции
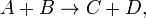 скорость можно выразить так:
скорость можно выразить так:
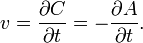
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Ферментативный катализ неразрывно связан с жизнедеятельностью организмов растительного и животного мира. Многие жизненно важные химические реакции, протекающие в клетке (что-то около десяти тысяч), управляются особыми органическими катализаторами, именуемыми ферментами или энзимами. Термину «особый» не следует уделять пристального внимания, так как уже известно, из чего построены эти ферменты. Природа избрала для этого один единственный строительный материал — аминокислоты и соединила их в полипептидные цепи различной длины и в разной последовательности
Это так называемая первичная структура фермента, где R — боковые остатки, или важнейшие функциональные группы белков, возможно, выступающие в качестве активных центров ферментов. На эти боковые группы и ложится основная нагрузка при работе фермента, пептидная же цепь играет роль опорного скелета. Согласно структурной модели Полинга — Кори, она свернута в спираль, которая в обычном состоянии стабилизирована водородными связями между кислотными и основными центрами:
Для некоторых ферментов установлены полный аминокислотный состав и последовательность расположения их в цепи, а также сложная пространственная структура. Но это все же очень часто не может помочь нам ответить на два главных вопроса: 1) почему ферменты так избирательны и ускоряют химические превращения молекул только вполне определенной структуры (которая нам тоже известна); 2) каким образом фермент снижает энергетический барьер, то есть выбирает энергетически более выгодный путь, благодаря чему реакции могут протекать при обычной температуре.
Строгая избирательность и высокая скорость — два основных признака ферментативного катализа, отличающие его от лабораторного и производственного катализа. Ни один из созданных руками человека катализаторов (за исключением, пожалуй, 2-оксипиридина) не может сравниться с ферментами по силе и избирательности воздействия на органические молекулы. Активность фермента, как и любого другого катализатора, тоже зависит от температуры: с повышением температуры возрастает и скорость ферментативной реакции. При этом обращает на себя внимание резкое снижение энергии активации Е по сравнению к некаталитической реакцией. Правда, это происходит не всегда. Известно много случаев, когда скорость возрастает благодаря увеличению не зависящего от температуры предэкспоненциального множителя в уравнении Аррениуса.
 2018-01-21
2018-01-21 879
879







