По числу молекул, принимающих участие в элементарном акте, реакции классифицируют на моно-, би- и тримолекулярные.
Мономолекулярными называются такие реакции, в которых химическому превращению подвергается одна молекула:
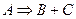
Кинетическое уравнение скорости для этого типа реакции имеет вид:
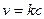
Бимолекулярные – такие реакции, в которых в элементарном акте встречаются две молекулы:
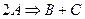
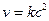
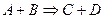
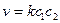
Тримолекулярные – реакции, в элементарном акте которых участвуют три молекулы (такие реакции встречаются редко):
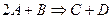
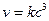
В кинетике различают реакции нулевого, первого, второго, третьего и дробного порядков. Порядок реакции – это число, равное сумме показателей степеней концентраций реагирующих веществ в основном кинетическом уравнении. Для процесса, описываемого уравнением:
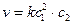
сумма показателей степеней равна 2 + 1 = 3, то есть это реакция третьего порядка.
Для простых по механи зму реакций величины молекулярности и порядка совпадают, но для сложных реакций порядок не соответствует молекулярности. Такое несоответствие может быть вызвано большим избытком одного из реагентов. Например, при гидролизе сахарозы:
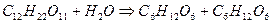
изменение концентрации воды так незначительно, что его можно не учитывать. Тогда основное кинетическое уравнение реакции можно записать:
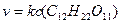
Следовательно, реакция гидролиза сахарозы является бимолекулярной реакцией первого порядка.
 2018-01-21
2018-01-21 660
660








