Экзергонические процессы – химические реакции, в результате которых уменьшается энергия Гиббса и система совершает работу.
Эндергонические процессы – химические реакции, в результате которых возрастает энергия Гиббса и над системой совершается работа.
Предмет и основные понятия химической кинетики. Химическое равночесие.
Предмет химической кинетики. Скорость реакции, средняя скорость в интервале, истинная скорость.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений
Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени:  .
.
Поскольку скорость реакции - величина положительная, то “+” ставится, если используется концентрация продуктов реакции, и “-” - для исходных веществ.
Например, для реакции 3H2+N2 = 2NH3.
 .
.
Средняя скорость в интервале – изменение концентрации реагирующих веществ за некоторый промежуток времени:
|
|
|
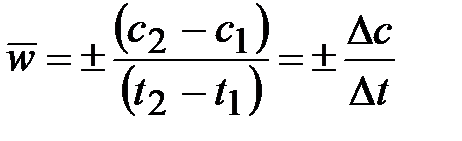 ,
,
Истинная скорость – изменение концентрации реагирующих веществ в конкретный момент времени и представляет собой предел средней скорости при Dt®0
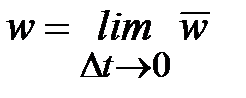 ,
,
Классификации реакций, применяющиеся в кинетике: реакции гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (последовательные, цепные, параллельные, сопряженные).
Различают реакции гомогенные, гетерогенные и микрогетерогенные:
Гомогенные – это реакции, протекающие в одной среде (нет поверхности раздела реагирующих веществ).

Гетерогенные – это реакции идущие между веществами в неоднородной среде. Например, на поверхности соприкосновения твердого тела и жидкости, газа и жидкости.
Определения различных типов катализа очень близки с отпределениями типов реакций
Выделяют микрогетерогенный катализ – в этом случае катализатор находится в каллойдном или высокомолекулярном состоянии. Примером служат биокаталитические процессы.
В общем, от сюда можно сформулировать такое определение для микрогетерогенных р-й.
Микрогетерогенные – это реакции идущие между веществами в неоднородной среде, между веществами в каллойдном или высокомолекулярном состоянии.
Различают простые и сложные реакции.
Простыми называют реакции, протекающие в одну стадию.
Сложными называют реакции, протекающие в несколько стадий.
Выделяют следующие виды сложных реакций:
1) параллельные; (характерно протекание нескольких процессов с участием одних и тех же исходных веществ. Эти процессы завершаются образованием разных продуктов реакции.)
|
|
|
2) последовательные, (В последовательных реакциях образование конечного продукта реакции из исходных веществ происходит не непосредственно, а через ряд промежуточных продуктов.)
3) сопряженные, (такие две реакции, из которых одна вызывает протекание в системе другой реакции, не осуществимой в отсутств ие первой.)
4) цепные.(Цепными называют реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой стадии, генерируют последующие стадии. Как правило, цепные реакции протекают с участием свободных радикалов. Для всех цепных реакций характерны три типичные стадии, которые мы рассмотрим на примере фотохимической реакции образования хлороводорода.)
 2018-01-21
2018-01-21 1748
1748








