Энтропия - мера энергетического беспорядка в системе, мера хаоса, мера той энергии, которая рассеивается в виде тепла и не превращается в работу.
энтропия – это количество энергии, рассеянной 1 моль вещества, отнесенное к 1 градусу.
S 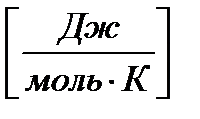
Энтропия – экстенсивная функция. Энтропия пропорциональна массе, её относят к 1 моль или 1 грамму вещества. Это означает, что энтропия системы равна сумме энтропий составных частей:
S = 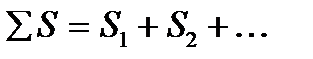
Энтропия является функцией состояния системы. Это значит, что  характеризует систему, а не процесс. Её изменение зависит только от начального и конечного состояния системы и не зависит от пути перехода:
характеризует систему, а не процесс. Её изменение зависит только от начального и конечного состояния системы и не зависит от пути перехода:
 .
.
Для химической реакции изменение энтропии: 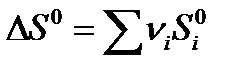 прод -
прод -  исх
исх
S= k In W Уравнение Больцмана
Второй закон термодинамики (второе начало термодинамики):
Самопроизвольно протекают процессы, приводящие к увеличению общей энтропии системы и окружающей среды
ΔSсист + ΔSсреды ≥ 0 или ΔS ≥ 0
k – константа Больцмана: k = 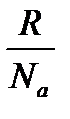 = 1,38∙10-23 Дж/градус;
= 1,38∙10-23 Дж/градус;
W – число микросостояний, с помощью которых можно реализовать данное макросостояние: W=1/Р;
Р – вероятность того, что система находится именно в этом микросостоянии.
Используя энергию Гиббса, второй закон термодинамики можно выразить так:
При постоянстве температуры и давления в системе самопроизвольно протекают только процессы, ведущие к уменьшению энергии Гиббса. В состоянии равновесия энергия Гиббса равна нулю.
Энергия Гиббса. Прогнозирование самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтрапийного факторов. Термодинамические условия равновесия.
Энергия Гиббса (или потенциал Гиббса) — это величина, показывающая изменение энергии в ходе химической реакции. G = U + PV - TS, где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия
G=H-TS
При ∆G<0 реакция самопроизвольно протекает в прямом направлении;
∆G>0 в обратном направлении
∆G=0 реакция находится в состоянии равновесия.
Изменение энергии Гиббса определяется формулой

Первое слагаемое называют энтальпийным фактором, второе – энтропийным фактором.
В изолированной системе самопроизвольно совершаются только такие процессы, при которых S возрастает, т.е. ∆S > 0 2.
Для закрытых систем необходимо учитывать 2 фактора, определяющих направление самопроизвольно протекающих процессов:
Энтальпийный – стремление системы к минимуму энергии за счет экзотермической реакции.
Энтропийный – к увеличению неупорядоченности в расположении частиц за счет теплового движения, поэтому новая функция состояния.
Уменьшению энергии Гиббса, а значит и самопроизвольному протеканию процесса, способствует уменьшение ∆Н (процессы с выделением тепла) и рост энтропии (процессы с ростом разупорядоченности в системе).
Стандартная энергия Гиббса химической реакции рассчитывается по формуле с использованием табличных данных:
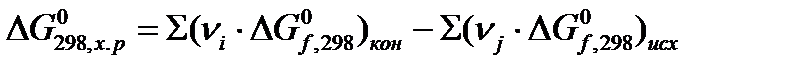
или
 ,
,
где

Термодинамическое равновесие — состояние системы, при котором ее параметры остаются неизменными сколь угодно долгое время при неизменности внешних условий.
Термодинамические условия равновесия: (вроде так, не нашла)
1. Постоянство концентрации
2. Постоянство давления
3. Постоянство температуры.
 2018-01-21
2018-01-21 2176
2176
