Молекулярность реакции - число молекул, реагирующих в одном элементарном акте реакции.
Для реакций различных порядков зависимость скорости от концентрации реагирующих веществ выражается индивидуальным кинетическим уравнением.
1) Реакции нулевого порядка (n=0).
Вид реакции: A®продукт; в этом случае скорость реакции не зависит от концентрации исходного вещества, т.е. концентрация вещества А поддерживается на одном уровне. Большая часть из них являются гетерогенными реакциями, протекающими на поверхности металла. Например, реакция разложения аммиака на H2 и N2 на поверхности вольфрама является реакцией нулевого порядка, т.е. её скорость на протяжении всего процесса не зависит от концентрации NH3.
Кинетическое уравнение:  или
или  ,
,
где k0 – константа скорости реакции нулевого порядка;
t – время от начала реакции до достижения концентрации с;
а - концентрация вещества А при t =0,
с - концентрация вещества А в момент времени t.
Размерность k 0 определяется выражением k 0 =w, поэтому 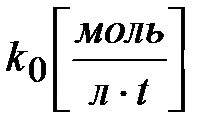 .
.
Время полупревращения t1/2 - время, за которое концентрация исходного вещества уменьшается в 2 раза.
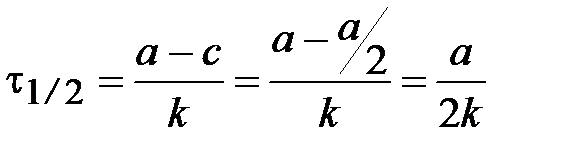 .
.
2) Реакции первого порядка (n=1).
Вид реакции: A ®продукт;
2H2O2  2H2O + O2
2H2O + O2
Кинетическое уравнение: 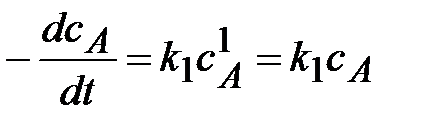 или
или 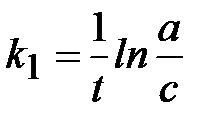 ,
,
Размерность константы скорости: k 1, [t-1].
Время полупревращения t1/2: 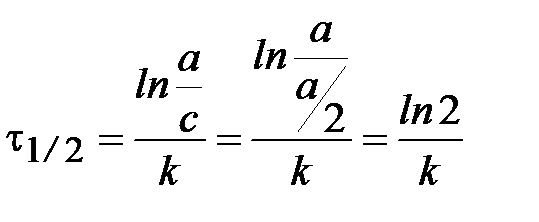 .
.
3) Реакции второго порядка (n=2).
Вид реакции: A + В ®продукт или 2 A ®продукт.
Реакции второго порядка – самый распространённый тип реакций. Вот примеры таких реакций
2NO2  2NO + O2
2NO + O2
H2 + I2  2HI
2HI
Пусть к началу реакциии концентрации исходных веществ равны 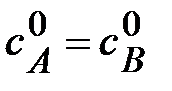 .
.
Кинетическое уравнение: 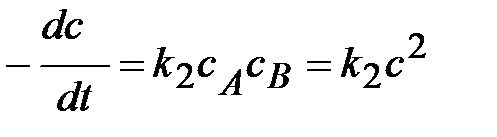 или
или 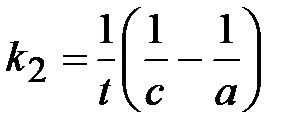 .
.
Размерность константы скорости: k 2, [конц.-1× t-1].
Время полупревращения t1/2: 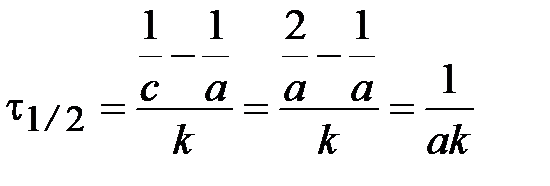 .
.
Размерность константы скорости: k 3, [конц.-2× t -1].
В общем случае 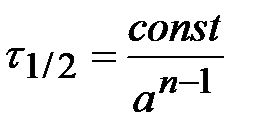 .
.
| Порядок реакции | Размерность константы |
| Нулевой | моль  л-1 л-1  время-1 время-1 |
| Первый | время-1 |
| Второй | л  моль-1 моль-1  время-1 время-1 |
| Третий | л2  моль-2 моль-2  время-1 время-1 |
 2018-01-21
2018-01-21 2477
2477
