Закон Бойля-Мариотта (1676 г.):
"при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объему газа р2/р1 = v1/v2 или pV = const".
Закон Гей-Люссака (1802 г.):
"при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре v1/T1 = v2/T2 или v/T = const".
Зависимость между v, p и Т можно выразить общим уравнением, объединяющим эти два закона:
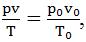
где р0, v0, Т0 - давление, объем и температура при н.у. Уравнение используется при решении задач для приведения газа к н.у.
Молярную массу газа вычисляют по уравнению Менделеева-Клапейрона: pv=nRT.
 2018-01-21
2018-01-21 334
334








