В состоянии химического равновесия
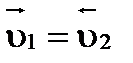 , тогда
, тогда 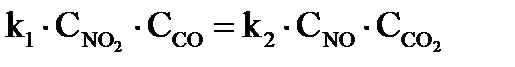 .
.
Поскольку k1 и k2 при данной температуре постоянны будет постоянным и их отношение
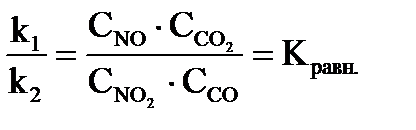
Кравн. – константа равновесия выражает закон действующих масс для процессов, находящихся в состоянии динамического равновесия. Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями.
Для гомогенных реакций в газообразной среде, вместо концентраций компонентов удобнее пользоваться величинами соответствующих парциальных давлений. Тогда константа равновесия для реакции аА+вВ  mM+nN будет
mM+nN будет
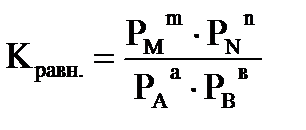
Р – парциальное давление.
Для реакций в гетерогенных системах с участием твердой и газообразной фаз давление твердой фазы ничтожно и основная его масса не участвует, поскольку взаимодействие протекает только с поверхности. Константу равновесия Кравн. можно выразить лишь через парциальное давление газообразных веществ, например:
С(тв)+СО2(г)=2СО(г)
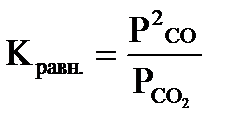
Константа равновесия является важной характеристикой химического взаимодействия. Чем больше значение Кравн., тем глубже протекает реакция, т.е. тем больше выход ее продуктов, для необратимых реакций Кравн.® к бесконечности. Если К®0, то это свидетельствует о практически полном отсутствии взаимодействия. Энергия Гиббса связана с константой равновесия соотношением
DG= -RT×lnKp
 2018-01-21
2018-01-21 667
667








