Существуют 2 метода составления уравнений окислительно-восстановительных реакций:
а) метод электронного баланса, основанный на сравнении степеней окисления атомов в исходных и конечных веществах. В основе этого метода лежит закон сохранения электрического заряда.
б) метод полуреакций (метод ионно-электронного баланса), основанный на составлении ионных уравнений для процессов окисления восстановителя и восстановления окислителя с последующим суммированием их в общее уравнение. В основе этого метода лежат законы сохранения массы и закон сохранения электрического заряда.
МЕТОД ПОЛУРЕАКЦИЙ:
а) Составить схему реакций с указанием исходных и образующихся веществ.
б) Определить степень окисления элементов в правой и левой частях схемы. Отметить элементы, степень окисления которых изменяется.
в) Записать уравнение в ионно-молекулярной форме. При этом сильные электролиты записывают в виде ионов, а слабые электролиты, твёрдые вещества, газы и комплексные ионы в молекулярной форме.
г) Составить уравнение процессов восстановления и окисления. Найти отношение числа электронов, принимаемых при восстановлении и отдаваемых при окислении.
д) Сложить уравнения окисления и восстановления с учётом найденного отношения числа электронов.
е) При составлении уравнений полуреакций из исходных соединений может высвобождаться кислород в форме аниона О-2. Тогда в кислых растворах он связывается в воду катионами водорода, а в щелочных и нейтральных растворах молекулами воды в гидроксид-ионы.
ж) Если же исходные соединения содержат меньше атомов О2, чем у образующихся соединений, то недостаток их восполняется.
з) Подобрать к полученному в пункте д) суммарному уравнению соответствующие ионы и проверить содержание кислорода в левой и правой частях полученного уравнения.
В периодах периодической системы с повышением порядкового номера элемента восстановительные свойства групп веществ понижаются, а окислительные – возрастают. В группах периодической системы с повышением порядкового номера элемента возрастают восстановительные свойства веществ, а окислительные – убывают.
Окислителями могут быть соединения высших, а восстановителями – низших степеней окисления, присущих данному элементу.
76. Электрохимические процессы. Гальванический элемент Якоби-Даниэля. Химические окислительно-восстановительные процессы, которые сопровождаются возникновением электрического тока, или сами называются им, называют электрохимическими.
Гальванический элемент – это устройство, в котором на основе окислительно-восстановительных реакций получают электрический ток, т.е. химическая энергия реакции превращается в энергию электрического тока.
Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции называется электродвижущей силой данного элемента.
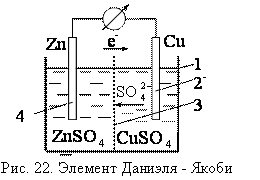
Электрод, на котором протекает процесс восстановления, называется катодом.
Причиной возникновения электрического тока в гальваническом элементе является разность потенциалов, возникающих на металлических электродах, которую называют разностью электродных потенциалов
77. Электродные потенциалы. Уравнение Нернста. Стандартный электродный потенциал. Электродный потенциал - разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
В случае электрохимических процессов полу-реакции окисления и восстановления, протекающие на соответствующих электродах называют электродными процессами.
Электродвижущие силы в случае гальванического элемента представляют в виде разности 2х величин, каждой их которых отвечают данные полу-реакции. Эти величины называются электродными потенциалами.
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов:
А) от природы реагирующих веществ участников электродного процесса;
Б) от соотношения между концентрациями (активностями) веществ;
В) от температуры.
φ=φ0+(2,3 RT/ZF)* lg([Ox]/[Red]) – уравнение Нернста.
φ0 – стандартный электродный потенциал процесса.
R – универсальная газовая постоянная.
T – постоянная температура.
Z – число электронов, участвующих в процессе.
F – число Фарадея. F=96500 Кл/моль.
Ox – концентрация в окислительной форме.
Red – концентрация вещества в восстановительной форме.
Стандартный электродный потенциал – это потенциал данного электродного процесса при концентрациях всех участвующих в нём веществ = 1.
Концентрации = 1, называются стандартными концентрациями.
Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного процесса принять = 0.
Для определения потенциала того иди иного электродного процесса необходимо составить гальванический элемент из испытуемого и стандартного водородного электрода и измерить его ЭДС. Таким образом, потенциал окислительно-восстановительной системы измерим по отношению к обратимому водородному электроду, принятому за 0, при условии когда отношения активностей окисленной и восстановленной форм =1, называется стандартным электродным окислительно-восстановительным потенциалом.
78. Водородный электрод. Измерение электродных потенциалов. Водородный электрод - это платиновая пластинка, электролитически покрытая губчатой платиной и погруженная в раствор кислоты, через который пропускается водород. Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются на атомы (платина катализирует этот распад).
Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
79. Электролиз. Реакции на катоде и аноде при электролизе. Электролиз определяют как окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав электролита.
Сущность электролиза состоит в осуществлении за счёт электрической энергии химических реакций – восстановления на катоде и окисления на аноде.
Необходимо различать электролиз расплава электролитов и электролиз водных растворов электролитов. В последнем случае в процессе электролиза могут участвовать молекулы воды.
NaCl=Na+Cl H2O
Na++1e=Na0 фик=-2,714В
2H2O+2e=H20+2OH- фик=-0,41В
На катоде при электролизе водного раствора NaCl будут восстанавливаться молекулы воды, а не ионы Na. Общее уравнение электролиза водного раствора NaCl записывается следующим образом:
2H2O+2Cl- = H2+Cl2+2OH-
2H2O+2NaCl Характер реакций в водных растворах электролитов, протекающих на катоде обусловлен положением металла в ряду стандартных электродных потенциалов металлов: чем меньше алгебраическая величина стандартного электродного потенциала металла, тем характернее для него ионное состояние и тем труднее восстанавливаются его ионы на катоде.
80. Электролиз растворов и расплавов солей. Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отливаются друг от друга. Отличие - в наличии растворителя. При электролизе растворов кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов - только ионы самого вещества.
Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита.
81. Законы Фарадея. Применение электролиза. Количественная сторона электролиза основывается на 2х законах Фарадея: А) количество вещества, окисленное на аноде, пропорционально прошедшему через раствор или расплав количеству электричества. Б) Количество окисляющихся и восстанавливающихся на электродах веществ при протекании одного и того же количества электричества пропорциональна их химических эквивалентам. Согласно законам Фарадея при электролизе количество веществ, выделяющихся на электродах не зависит от температуры и концентрации раствора.
Электролиз нашел широкое применение в промышленности: А) при получении металлов, имеющих сильно отрицательные электродные потенциалы электролизом расплава их солей. Б) при электролитическом выделении металлов из растворв их солей (электро-экстракция). В) при электролитической очистке металлов (электро-рафинирование). Г) при нанесении на поверхность металлов слоёв других металлов (гальваностедия). Д) при получении точной металлической копии с рельефных предметов путём электроосаждения металлов (гальванопластика). Е) электрохимическое полирование.
 2018-01-21
2018-01-21 1807
1807
