Раствор – газообразная, твёрдая или жидкая гомогенная система состоящая из 2-х или более элементов относительное содержание которых может изменяться в неограниченных пределах. Он состоит из растворённого вещества и растворителя, в котором это вещество равномерно распределено в виде молекул и ионов.
Важной характеристикой любого раствора является его состав, который выражается концентрацией.
Массовая доля – отношение массы растворённого вещества X к общей массе раствора m:  (обычно выражается в процентах %)
(обычно выражается в процентах %)
Мольная доля – отношение количества растворённого вещества X к сумме количеств всех компонентов в растворе:  , где
, где  – молярная масса для 2-х компонентов.
– молярная масса для 2-х компонентов. 
Молярная концентрация – отношение количества растворённого вещества к объёму раствора:  (выражается в
(выражается в  , например, 2 М
, например, 2 М 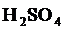 , в единице раствора 2моля
, в единице раствора 2моля  ). Эквивалентная (нормальная) концентрация – отношение количества эквивалентов растворённого вещества к объёму раствора:
). Эквивалентная (нормальная) концентрация – отношение количества эквивалентов растворённого вещества к объёму раствора:  (выражается в
(выражается в 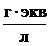 )
)
20 ) Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированныерастворы; насыщенныйраствор.
Идеальным раствором называют раствор, для которого выполняется первый закон Рауля.
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Свойства разбавленных растворов неэлектролитов. В этих р-рах взаимодействием между растворителем и растворяемым веществом можно пренебречь. Такие р-ры можно рассматривать как результат механического перемешивания, не сопровождающегося тепловым эффектом. В таких р-рах происходит диффузия. Движущей силой диффузии является стремление компонентов р-ра к возрастанию энтропии. Осмос – односторонняя диффузия через полупроницаемую мембрану(например проникновение  в сахарозу). Давление, которое нужно приложить к р-ру, чтобы прекратился осмос называется осмотическим. Р-ры с одинаковым осмотическим давлением называются изотопическими. Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества. Химическое равновесие – состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
в сахарозу). Давление, которое нужно приложить к р-ру, чтобы прекратился осмос называется осмотическим. Р-ры с одинаковым осмотическим давлением называются изотопическими. Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества. Химическое равновесие – состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
 2018-01-21
2018-01-21 933
933








