При взаимодействии частиц наблюдается взаимная координация частиц, которую можно определить как процесс комплексообразования. Например, процесс гидратизации ионов заканчивается образованием аквакомплексов. Реакции комплексообразования сопровождаются переносом электронных пар и приводят к образованию или разрушению соединений высшего порядка, так называемых комплексных (координационных) соединений.
Особенностью комплексных соединений является наличие в них координационной связи возникшей по донорно–акцепторному механизму:
М + ¯L ® М¯L
акцептор донор комплекс
Процессы комплексообразования сказываются практически на свойствах всех частиц, образующих комплекс. Чем выше прочность связей лиганда и комплексообразователя, тем в меньшей степени в растворе проявляются свойства центрального атома и лигандов и тем заметнее сказываются особенности комплекса.
Комплексные соединения проявляют химическую и биологическую активность в результате координационной ненасыщенности центрального атома (имеются свободные орбитали) и наличия свободных электронных пар лигандов. В этом случае комплекс обладает электро-фильными и нуклеофильными свойствами, отличными от свойств центрального атома и лигандов.
|
|
|
Необходимо учитывать влияние на химическую и биологическую активность строения гидратной оболочки комплекса. Процесс образова-
ния комплексов оказывает влияние на кислотно-основные свойства комплексного соединения. Образование комплексных кислот сопровождается увеличением силы кислоты или основания соответственно.
Комплексы проявляют окислительно-восстановительные свойства за счет окислительно-восстановительных превращений комплексо-образователя, образующего устойчивые степени окисления. Процесс комплексообразования сильно влияет на величины восстановительных потенциалов d-элементов. Если восстановленная форма катионов образует с данным лигандом более устойчивый комплекс, чем его окисленная форма, то величина потенциала возрастает. Снижение величины потенциала происходит, когда более устойчивый комплекс образует окисленная форма. Например, под действием окислителей: нитритов, нитратов, NO2, H2O2 гемоглобин в результате окисления центрального атома превращается в метгемоглобин.
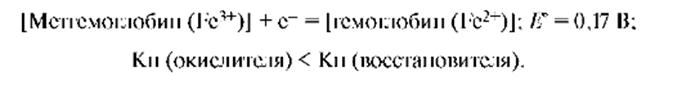
23. НОМЕНКЛАТУРА ХИМИЧЕСКАЯ -совокупность названий индивидуальных хим. в-в, их групп и классов, а также правила составления этих названий.
Номенклатура неорганических соединений. В основе назв. неорг. в-в лежат рус.назв. хим. элементов (см. Периодическая система химических элементов,Элементы химические), к-рые в большинстве случаев совпадают с латинскими. Исключениями являются корни иноязычных назв. "анти-мон" (сурьма), "аргент" (серебро), "аре" или "арсин" (мышьяк), "аур" (золото), "гидр" (водород), "карб" или "карбон" (углерод), "купр" (медь), "манган" (марганец), "меркур" (ртуть), "нитр" (азот), "оке" или "оксиген" (кислород), "плюмб" (свинец), "сил", "силиц" или "силик" (кремний), "станн" (олово), "стиб" (сурьма), "сульф" или "тио" (сера) и "ферр" (железо). Примеры: антимонид, карбид, карбонат, силан, силицид, силикат, стибин; исключения: назв. "азид" и "озонид". Для соединения Хе, Мо и Р используют усеченные корни рус. назв. (перксенат, молибдат, фосфид). Производные изотопов водорода называют, используя корни "дейтер" или "дейтерио" и "трит" или "три-тио".
|
|
|
В ф-лах хим. соед. обычно первым указывают электро-положит. элемент или катион, а затем электроотрицательный или анион, напр. NaCl, Аl2(SО4)3. Стехиометрич. соотношения в ф-лах, как правило, выражают целыми числами, а сами ф-лы дают без учета степени ассоциации соединений
Название соед. дают двумя словами: электроотрицат. элемент или анион и электроположит. элемент или катион. Назв. электроотрицат. части соед. образуют с помощью суффиксов "ид" или "ат", назв. электроположит. части дают в родительном падеже. В случае необходимости используют числовые префиксы "геми", "моно" (обычно опускают), "сескви", "ди", "три", "тетра" и т.д., а когда возможно неоднозначное понимание - умножающие числовые префиксы "бис", "трис", "тетракис" или в скобках после назв. элемента (чаще всего металла) указывают римскими цифрами степень его окисления. Примеры: NaCl-хлорид натрия, К2[ZrF6]-гексафтороцирконат калия, SiСl4-тетрахлорид кремния, СrО3-триоксид хрома, оксид xpoMa(VI), P2O5-оксид фосфора(V).
П р о с т ы е в-в а наз., как правило, аналогично хим. элементам. Чтобы различить число атомов в молекуле, используют прилагательные "атомный", "молекулярный" и тра-диц. назв., напр.: Н-атомный водород, О2-молекулярный кислород, Sn- аморфная сера, Р4- белый фосфор, О3-озон.
Среди оксидов исключениями являются Н2О-вода, соед. с ионами О22--пероксиды и О-3-озониды. Мн. гидриды называют, прибавляя суффиксы "ан" или "ин": ВН3-боран, SiH4-силан, SnН4-станнан, РН3-фосфин, AsH3-арсин, SbH3-стибин. Для обозначения числа атомов Н используют числовые префиксы или скобки: В2Н6-диборан,диборан(6), Si3Н8-трисилан(8), В5Н9-пентаборан(9), В5Н11-пентабо-ран(11). Исключениями среди нитридов являются NH3-аммиак, N2H4-гидразин, НN3-азидоводород, среди сульфидов-H2S-сероводород, H2S2-дисульфан, Н2S3-трисуль-фан и т.п. Это же относится к Н2Sе-селеноводород, Н2Те-теллуроводород и р-рам Н2S, Н2Sе, Н2Те в воде-сероводородная, селеноводородная и теллуроводородная к-ты. Назв. интерметаллидов, кроме простейших, повторяют их ф-лы, напр.: SmСо5-самарий-кобальт-пять.
Многие бинарные соед. в действительности являются комплексными, что обусловливает двойственность их названия: NiF3 или Ni[NiF6]-трифторид никеля, гексафторо-никелат(IV) никеля(II).
П с е в д о б и н а р н ы е с о е д. включают псевдогалогениды (ионы к-рых образованы устойчивыми атомными группами, напоминающими по св-вам галогены),гидроксиды и др., напр.: Fе(СN)2-дицианид железа, цианид железа(II), NaOH-гидроксид натрия. Назв. соед. с ионами NH+2 (амид) и NH+ (имид) образуются особо: NH2Cl-хлорамин, NHI2-иодимид.
К и с л о р о д с о д е р ж а щ и е к-т ы называют по традиционной рус. номенклатуре путем присоединения к корню рус. назв. хим. элемента окончания "ная", "овая", "евая" (высшая или единств. степень окисления элемента), "новатая" (промежут. степень), "(ов)истая" и "новатистая" (низшая степень), напр.: Н2SО4-серная, НМnО4-марганцовая, H2GeO3-германиевая, HClO, - хлорноватая, НСlО2 - хлористая, HNO2-азотистая, НСlО-хлорноватистая к-та. Традиционные названия сохраняются и для др. к-т, напр.: Н2СО3-угольная, НАuСl6 - золотохлористоводородная, НВF4 -борофтористоводородная, H2SiF6 - кремнефтористоводо-родная, НSО3Сl-хлорсульфоновая. К-ты, образованные переходными металлами, наз. с указанием степени их окисления: НRеО4-рениевая(VII), Н2RеО4-рениевая(VI), НRеО3-рениевая(V). К-ты с элементом водной и той же степени окисления, но содержащие разл. формальное кол-во воды, различают префиксами "орто" (большое кол-во) или "мета" (малое кол-во), напр.: Н3АsО3-ортомышьяковистая, HAsO2 - метамышьяковистая к-та.
|
|
|
С р е д н и е с о л и называют, сочетая назв. аниона и катиона. Если элемент, образующий анион, имеет разл. степени окисления, то для высшей и низшей из двух при использовании традиционных назв. применяют суффиксы "ат" и "ит" (На2SеО4-селенат, Na2SeO3-селенит), при наличии трех степеней окисления для низшей используют префикс "гипо" и суффикс "ит" (NaNO2-нитрит, Nа2N2О2-гипонитрит натрия); при четырех разл. степенях окисления для высшей применяют префикс "пер" и суффикс "ат" (КСlО4-перхлорат, КСlО3-хлорат калия). Во всех остальных случаях для назв. аниона используют суффикс "ат" и указывают степень окисления анионообразующего элемента римскими цифрами в скобках [арсенат(III), арсенат(V), феррат(II), феррат(III)]. В назв. солей могут сохраняться префиксы "орто", "мета" и др.
К и с л ы е и о с н о в н ы е с о л и содержат в назв. префикс соотв. "гидро" или "гидроксо": KHSO4- гидросульфат калия, КаН2РО4-дигидрофосфат натрия, КН2F3-дигидро-трифторид калия, К[Аu(ОН)4]-тетрагидроксоаурат(III) калия, Fе(ОН)NО3-гидроксонитрат железа(II), Сu2(ОН)2СО3-дигидроксокарбонат меди(II).
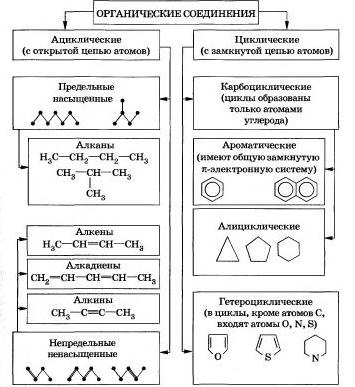
24. Основные классы органических соединений биологического происхождения — белки, липиды, углеводы, нуклеиновые кислоты — содержат, помимо углерода, преимущественноводород, азот, кислород, серу и фосфор. Именно поэтому «классические» органические соединения содержат прежде всего водород, кислород, азот и серу — несмотря на то, чтоэлементами, составляющими органические соединения, помимо углерода могут быть практически любые элементы.
|
|
|
Соединения углерода с другими элементами составляют особый класс органических соединений — элементоорганические соединения. Металлоорганические соединения содержат связь металл-углерод и составляют обширный подкласс элементоорганических соединений.
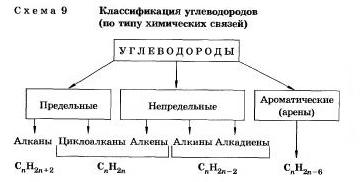
Классификация органических веществ
(по строению углеродной цепи молекул)
Спирты — производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильные группы.
Спирты называют одноатомными, если они имеют одну гидроксильную группу, и предельными, если они — производные алканов.
Общая формула предельных олноатомных спиртов:
К—ОН.
Фенолы — производные ароматических углеводородов (ряда бензола), в котором один или несколько атомов водорода в бензольном кольце замещены на гидроксильные группы.
Альдегиды и кетоны — производные углеводородов, содержащие карбонильную группу атомов (карбонил).
В молекулах альдегидов одна связь карбонила идет на соединение с атомом водорода, другая — с углеводородным радикалом.
В случае кетонов карбонильная группа связана с двумя (в общем случае разными) радикалами, общая формула кетонов:

Простые эфиры представляют собой органические вещества, содержащие два углеводородных радикала, соединенные атомом кислорода: R=О—R или R—О—R2.
Радикалы могут быть одинаковыми или разными. Состав простых эфиров выражается формулой СnН2n+2O.
Сложные эфиры — соединения, образованные замещением атома водорода карбоксильной группы в карбоновых кислотах на углеводородный радикал.
Общая формула сложных эфиров:

Нитросоединения — производные углеводородов, в которых один или несколько атомов водорода замещены на нитрогруппу —N02.
Амины — соединения, которые рассматривают как производные аммиака, в котором атомы водорода замещены на углеводородные радикалы.
В зависимости от природы радикала амины могут быть алифатическими. В зависимости от числа замещенных на радикалы атомов водорода различают первичные амины, вторичные, третичные.
В частном случае у вторичных, а также третичных аминов радикалы могут быть и одинаковыми.
Первичные амины можно также рассматривать как производные углеводородов (алканов), в которых один атом водорода замещен на аминогруппу.
Аминокислоты содержат две функциональные группы, соединенные с углеводородным радикалом, — аминогруппу —NH2 и карбоксил -ССОН.
25.Высокомолекулярными соединениями, или полимерами, называют сложные вещества с большими молекулярными массами (порядка сотен, тысяч и миллионов), молекулы которых построены из множества повторяющихся элементарных звеньев, образующихся в результате взаимодействия и соединения друг с другом одинаковых или разных простых молекул — мономеров.
Следующие два процесса приводят к образованию высокомолекулярных соединений: а) реакция полимеризации — процесс, в результате которого молекулы низкомолекулярного соединения (мономера) соединяются друг с другом при помощи ковалентных связей, образуя новое вещество (полимер), молекулярная масса которого в целое число раз больше, чем у мономера; полимеризация характерна, главным образом, для соединений с кратными (двойными или тройными) связями; б) реакций поликонденсации — процесс образования полимера из низкомолекулярных соединений, содержащих две или несколько функциональных групп, сопровождающийся выдедедием за счет этих групп таких веществ, как вода, аммиак, галогеноводород и т. п.; состав элементарного звена полимера в этом случае отличается от состава исходного мономера.
Примерами природных высокомолекулярных соединений могут служить крахмал и целлюлоза, построенные из элементарных звеньев, являющихся остатками моносахарида (глюкозы), а также белки, элементарные звенья которых представляют собой остатки аминокислот; сюда же относятся природные каучуки (см. ниже).
Все большее значение приобретают синтетические  сокомолекулярные соединения или, как их иначе называют, синтетические высокополимеры. Это разнообразные материалы, обычно получаемые из доступного и дешевого сырья; на их основе получают пластические массы - сложные композиции, в которые вводят различные наполнители и добавки, придающие полимерам необходимый комплекс технических свойств, — а также синтетические волокна
сокомолекулярные соединения или, как их иначе называют, синтетические высокополимеры. Это разнообразные материалы, обычно получаемые из доступного и дешевого сырья; на их основе получают пластические массы - сложные композиции, в которые вводят различные наполнители и добавки, придающие полимерам необходимый комплекс технических свойств, — а также синтетические волокна
Полимеризационные смолы. К полимеризационным смолам относятся полимеры, получаемые реакцией полимеризации преимущественно этиленовых углеводородов или их производных.
Полимеры - высокомолекулярные соединения (ВМС), с молекулярной массой от нескольких тысяч до многих миллионов. Молекулы полимеров состоят из большого числа повторяющихся звеньев. Олигомеры занимают промежуточное положение между низкомолекулярными соединениями и ВМС, молекулы их содержат 2 или несколько структурных звеньев.
26.Первый постулат Бора гласит: существуют особые, станционарные состояния атома, находясь в которых атом не излучает энергию, при этом электроны в атоме движутся с укорением. Каждому стационарному состоянию соответствует определенная энергия Еn.
Согласно второму постулату Бора излучение света происходит при переходе атома из стационарного состояния с большей энергией Еn в стационарное состояние с меньшей энергией Еn. Энергия излученного фотона равна разности энергий стационарных состояний:
hvkn = Ek - En
Недостатки теории бора:-не были учтены волновые свойства электронов,модель только для атома водорода.
Квант энергии- конечное ол-во энергии, которое может быть отдано или поглощено микро системой в отдельном акте изменения ее состояние.
Атомные спектры-оптические спектры, получ-ся при испускании или поглощении ЭМИ свободными ли слабо связанными атомами.
Молекулярные спектры-спектры испускания и поглощения ЭМИ и комбинаций рассеяния света, принадлежащие свободным или слабо связанным молекулам
 2018-01-21
2018-01-21 915
915








