Коллоквиум IV
ЭЛЕКТРОХИМИЯ
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Электрохимия - это раздел физической химии, изучающий закономерности взаимопревращений электрической и химической форм энергии. В химических реакциях, идущих под действием электрического тока (т. е. при электролизе), электрическая энергия превращается в химическую. В гальванических элементах электрическая энергия вырабатывается в результате протекания химических реакций. Общей чертой электрохимических процессов является участие в них двух соприкасающихся фаз, между которыми происходит материальный обмен молекулами или ионами. Все эти процессы идут в растворах или расплавах электролитов и связаны с изменением состояния ионов. Поэтому в электрохимии изучаются свойства растворов электролитов, ионные равновесия, электродные процессы.
Электропроводность растворов электролитов
Электролиты – вещества, растворы или расплавы которых обладают ионной проводимостью. По сравнению с металлами (сплавами металлов), проявляющими электронную проводимость и являющимися проводниками первого рода, электролиты относят к проводникам второго рода. Типичные проводники второго рода – это растворы кислот и оснований, расплавы и растворы солей. Так как все биологические жидкости и ткани организма обладают ионной проводимостью, то они относятся к растворам электролитов.
Важным свойством растворов электролитов является электрическая проводимость (электропроводность), которая характеризует их способность проводить электрический ток. Она является величиной, обратной электрическому сопротивлению. В свою очередь, сопротивление проводника любого вида R (согласно закону Ома) пропорционально его длине (l) и обратно пропорционально площади сечения (S):
 | (4.1) |
где ρ – удельное сопротивление, равное R при единичных длине и площади сечения проводника, Ом · м.
Различают удельную, эквивалентную и молярную электропроводность. Величина, обратная удельному сопротивлению (r), называется удельной электропроводностью (k, «каппа») и представляет электропроводность раствора электролита, помещенного между параллельными электродами площадью 1 м2, находящимися на расстоянии 1 м.
 | (4.2) |
Для характеристики электропроводности растворов электролитов чаще используют молярную электропроводность (λ, «ламбда»), т. е. электропроводность раствора, содержащего 1 моль электролита, помещенного между параллельными электродами, расположенными на расстоянии 1 м. "Рабочая" площадь электродов определяется объемом раствора. Молярная электропроводность связана с удельной электропроводностью следующим соотношением:
 | (4.3) |
где С – молярная концентрация раствора, моль/л; V – разведение (разбавление) раствора, т. е. объем раствора, в котором растворен один моль электролита, м3/моль.
Если между электродами, расположенными на расстоянии 1 м друг от друга, содержится 1 моль-эквивалент электролита, то электропроводность раствора называется эквивалентной. Она связана с удельной электропроводностью соотношением (4.3) и имеет размерность Ом-1×м2×моль-экв-1.
Электропроводность растворов зависит от ряда факторов: природы растворителя, вязкости и температуры среды, радиуса и концентрации ионов в растворе. На кривых зависимости удельной электропроводности от концентрации (рис. 4.1) обычно наблюдается максимум.
|
|
|
|
|
Рис. 4.1. Зависимость удельной электропроводности от концентрации
для некоторых электролитов
С увеличением концентрации раствора удельная электропроводность сначала растет за счет увеличения числа ионов, достигая максимального значения. При дальнейшем увеличении концентрации сильных электролитов межионное взаимодействие возрастает настолько сильно, что приводит к снижению скорости движения ионов и уменьшению величины удельной электропроводности раствора. В растворе слабых электролитов скорость движения ионов мало зависит от концентрации, однако с ее увеличением уменьшается степень диссоциации, что также приводит к снижению величины удельной электропроводности.
Молярная (эквивалентная) электропроводность растворов электролитов при разбавлении раствора (уменьшении концентрации) увеличивается (рис. 4.2), достигая при бесконечном разбавлении максимального постоянного значения.
|
|
|
|
|
Рис. 4.2. Зависимость молярной электропроводности от разбавления
для некоторых электролитов
Это значение является определенным для каждого электролита и называется эквивалентной электропроводностью при бесконечном разбавлении (обозначается  ). В разбавленных растворах сильных электролитов выполняется эмпирический закон Кольрауша (закон квадратного корня):
). В разбавленных растворах сильных электролитов выполняется эмпирический закон Кольрауша (закон квадратного корня):
 | (4.4) |
где А – константа (при данной температуре) для данного электролита и растворителя.
Электропроводность электролитов связана со скоростями движения ионов в растворе. В бесконечно разбавленном растворе достигается полная диссоциация молекул и взаимодействие между ионами отсутствует. Каждый из ионов движется независимо от других, и молярная (эквивалентная) электропроводность в таком случае может быть представлена как сумма электропроводностей ионов. Та часть электропроводности, которая приходится на ионы одного вида, называется подвижностью (l) иона.
Согласно закону Кольрауша о независимости движения ионов, величина l¥ равна сумме подвижностей катиона (l+¥) и аниона (l–¥):
 | (4.5) |
Физический смысл закона Кольрауша заключается в том, что в растворе электролита ионы переносят электрический ток независимо друг от друга.
Подвижности ионов связаны с абсолютными скоростями движения ионов (U):
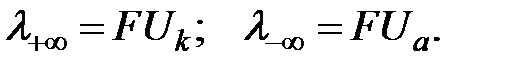 | (4.6) |
Под абсолютной скоростью движения ионов понимают скорость их движения при градиенте напряженности электрического поля 1 В/м. Единицей измерения абсолютной скорости является м2В–1с–1. Сравнение абсолютных скоростей движения различных ионов или их подвижностей показало, что они зависят от заряда и радиуса иона. Чем больше заряд и радиус иона и чем выше степень его гидратации, тем меньше подвижность. При этом было установлено также увеличение скорости движения ионов одинакового заряда с ростом кристаллографического радиуса  что объясняется гидратированием ионов в водных растворах, причем ионы меньшего радиуса гидратируются в большей степени.
что объясняется гидратированием ионов в водных растворах, причем ионы меньшего радиуса гидратируются в большей степени.
Предельные подвижности ионов водорода и гидроксид-ионов в водных растворах в несколько раз превышают подвижности других ионов. Это явление объясняется особым эстафетным механизмом их движения, согласно которому в кислой среде осуществляется перенос протона от иона гидроксония к соседней, соответствующим образом ориентированной молекуле воды:
 |
Аналогический перенос протона от молекулы воды к иону гидроксида происходит в щелочной среде:
 |
Таким образом, при наложении электрического поля происходит не просто перемещение ионов H+ и OH-, а скачкообразный переход протона от  или нейтральных молекул воды к соседним молекулам. В связи с тем, что отрыв протона от иона гидроксония происходит легче, чем от нейтральных молекул воды, подвижность ионов H+ больше, чем подвижность ионов OH-.
или нейтральных молекул воды к соседним молекулам. В связи с тем, что отрыв протона от иона гидроксония происходит легче, чем от нейтральных молекул воды, подвижность ионов H+ больше, чем подвижность ионов OH-.
В растворах слабых электролитов молярная электропроводность при данном разбавлении ( 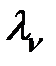 ) пропорциональна степени его диссоциации (α):
) пропорциональна степени его диссоциации (α):
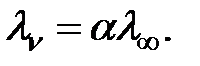 | (4.7) |
Степень диссоциации слабого электролита можно рассчитать по уравнению Аррениуса:
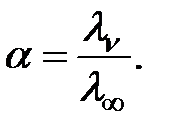 | (4.8) |
Значение 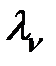 определяют экспериментально, а
определяют экспериментально, а  рассчитывают по справочным таблицам, пользуясь уравнением (4.5).
рассчитывают по справочным таблицам, пользуясь уравнением (4.5).
Кроме того, для слабых электролитов выполняется закон разведения Оствальда, который для бинарного электролита записывается следующим образом:
 | (4.9) |
Подставляя значение a в уравнение (4.9), получают еще одну из форм закона разведения Оствальда для расчета константы диссоциации:
 | (4.10) |
 2018-01-21
2018-01-21 31279
31279