Вода - химическое соединение. Связь имеет ковалентный характер.
Вода служит отличным растворителем для многих веществ, благодаря значительному дипольному моменту. Процесс растворения называется гидратацией, а те вещества, которые вступают в реакции гидратации, чаще всего являются электролитами (проводят электрический ток).
1. Кислотно-основные реакции. Вода обладает амфотерностью, поэтому может вступать в реакции с кислотами и с основаниями:
BaO + H2O = Ba(OH)2,
N2O5+ H2O = 2HNO3.
2. Вода реагирует практически со всеми солями, образуя гидраты:
CaCl2+ 6H2O=CaCl2·6H2O.
3. Вода окисляет металлы, стоящие в ряду напряжения до олова. С щелочными металлами (Na,Li,K) бурно реагирует:
2K+H2O=2KOH+H2.
С менее активными с металлами вода реагирует при нагреве:
Ca + 2H2O = Ca(OH)2+Н2.
Пероксид водорода – тяжелая жидкость голубого цвета Н2О2.
Связи в пероксиде сильно ассоциированы из-за наличия водородных связей. Пероксидводорода смешивается с водой в неограниченных количествах.
Если чистое вещество попадает на оголенный участок кожи, то чувствуется неприятное жжения, вследствие чего возникает сильный химический ожог.
Изначально была получена в 1818 году французским химиком Луи Жак Тенаром в процессе окисления пероксида бария охлажденной соляной кислотой.
На сегодняшний день используют способ получения перекиси с помощью концентрированной серной кислоты (лабораторный):
BaO2+H2SO4=BaSO4+H2O2.
Пергидроль – 30% раствор H2O2 в воде. Он взрывоопасен, повреждает кожу при попадании, вызывает химические ожоги (места повреждения белеют).
Его часто используют как катализатор, так как пероксид быстро разлагается (часто со взрывом) под действием многих веществ (металлов), даже в макроскопических количествах.
Вопрос
На́трий — элемент первой группы (по старой классификации — главной подгруппы первой группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11. Обозначается символом Na (лат. Natrium). Простое вещество натрий (CAS-номер: 7440-23-5) — мягкий щелочной металл серебристо-белого цвета.
Щелочной металл на воздухе легко окисляется до оксида натрия. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина.
При горении на воздухе или в кислороде образуется пероксид натрия:

Кроме того, существует озонид натрия NaO3.
С водой натрий реагирует очень бурно, помещённый в воду кусочек натрия всплывает, из-за выделяющегося тепла плавится, превращаясь в белый шарик, который быстро движется в разных направлениях по поверхности воды[14], реакция идёт с выделением водорода, который может воспламениться. Уравнение реакции:

Как и все щелочные металлы, натрий является сильным восстановителем и энергично взаимодействуют со многими неметаллами (за исключением азота, иода, углерода, благородных газов):
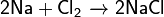
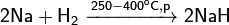
Натрий более активен, чем литий. С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия (в противоположность легко образующемуся нитриду лития):

С разбавленными кислотами взаимодействует как обычный металл:
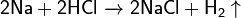
С концентрированными окисляющими кислотами выделяются продукты восстановления:

Растворяется в жидком аммиаке, образуя синий раствор:

С газообразным аммиаком взаимодействует при нагревании:
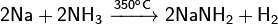
С ртутью образует амальгаму натрия, которая используется как более мягкий восстановитель вместо чистого металла. При сплавлении с калием даёт жидкий сплав.
Алкилгалогениды с избытком металла могут давать натрийорганические соединения — высокоактивные соединения, которые обычно самовоспламеняются на воздухе и взрываются с водой. При недостатке металла происходит реакция Вюрца.
Растворяется в краун-эфирах в присутствии органических растворителей, давая электрид или алкалид (в последнем у натрия необычная степень окисления −1).
Роль натрия в организме:
1. Способствует поддержанию осмотического давления в жидкостях организма и водного баланса, транспортирует аминокислоты, глюкозу, различные неорганические и органические анионы через мембраны клеток. Формирует потенциал действия посредством обмена с ионами калия.
2. Транспортирует углекислый газ.
3. Оказывает влияние на обмен белков, участвуя в процессе гидратации.
Натрий принимает участие в синтезе желудочного сока, координирует выделение почками продуктов обмена веществ, активизирует некоторые ферменты поджелудочной железы и слюнных желез, участвует в обеспечении щелочных резервов плазмы крови.
Натрий полностью усваивается в организме, а также проникает через легочный эпителий и кожу. Его усвоению способствуют витамины K, D.
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии[1]. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:

2. Взаимодействие металлического натрия с нитратом натрия:

3. Прокаливание пероксида натрия с избытком натрия:

4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
1. Взаимодействие с водой с образованием щёлочи:

2. Взаимодействие с кислотными оксидами с образованием соли:

3. Взаимодействие с кислотами с образованием соли и воды:

Натрия гидроксид – это всем известная каустическая сода, самая распространенная щелочь в мире. Химическая формула NaOH. Имеет другие традиционные названия – каустик, едкая щелочь, едкий натр, гидроокись натрия, натриевая щелочь. Едкий натр – это твердое вещество белого или желтоватого цвета, немного скользкое на ощупь, которое получают путем электролиза из хлорида натрия. Натрия гидроксид является сильной щелочью, которая способна разрушать органические вещества: бумагу, дерево, а также кожу человека, вызывая ожоги различной степени тяжести. Свойства гидроксида натрия Промышленность выпускает гидроокись натрия в виде белого рассыпчатого порошка без запаха. Технический едкий натр может поставляться в виде различных растворов: ртутных, химических, диафрагменных. Обычно это бесцветная или слабо окрашенная жидкость, герметически закупоренная в щелочеустойчивую тару. Также выпускается гранулированный гидроксид натрия, который служит для различных технических нужд. Каустик является водорастворимым веществом, которое при контакте с водой выделяет большое количество теплоты. Раствор натриевой щелочи немного скользкий на ощупь, напоминает жидкое мыло. Другие свойства гидроксида натрия Нерастворим в ацетоне, эфирах; Хорошо растворяется в глицерине, этаноле и метаноле (спиртовые растворы); Каустик очень гигроскопичен, поэтому соду нужно упаковывать в непромокаемую тару и хранить в сухом помещении; Негорюч, температура плавления - 318°С; Температура кипения - 1390°С; Опасное свойство гидроксида натрия заключается в его бурной реакции при контакте с металлами, такими как алюминий, цинк, свинец, олово. Являясь сильным основанием, едкий натр может образовывать взрывоопасный горючий газ (водород); Пожароопасная ситуация возникает и в случае контакта натриевой щелочи с аммиаком; В расплавленном виде может разрушать фарфор и стекло. В промышленных масштабах следует осторожно пользоваться этим веществом, поскольку не соблюдение мер безопасности опасно для человека. Применение гидроксида натрия В пищевой промышленности натриевая щелочь известна как пищевая добавка – регулятор кислотности Е-524. Она используется при производстве какао, карамели, мороженого, шоколада и лимонадов. Также каустическую соду добавляют в хлебобулочные изделия и сдобу для более пышной консистенции, а обработка изделий раствором едкого натра перед выпечкой способствует приобретению хрустящей румяной корочки. Применение гидроксида натрия целесообразно для получения нежной и мягкой консистенции продуктов. Например, вымачивание рыбы в щелочном растворе позволяет получить желеобразную массу, из которой готовят лютефиск – традиционное скандинавское блюдо. Таким же способом добиваются размягчения маслин и оливок. Достаточно широко гидроокись натрия применяется в косметической промышленности. При производстве средств личной гигиены (мыло, шампуни, кремы), а также моющих средств гидроокись натрия необходима для омыления жиров и присутствует в качестве эмульгирующей щелочной добавки. Другие сферы применения гидроксида натрия: В целлюлозно-бумажной промышленности; Для производства масел и изготовления биодизельного топлива в нефтеперерабатывающей промышленности; Для дезинфекции и санитарной обработки помещений, поскольку каустическая сода имеет свойство нейтрализовывать находящиеся в воздухе вредные для человека вещества; В быту для очистки засорившихся труб, а также для ликвидации загрязнений с различных поверхностей (кафель, эмаль и пр.).
Соли натрия и калия
Натрий и калий образуют соли со всеми кислотами. Соли натрия и калия очень похожи по химическим свойствам. Характерная особенность этих солей – хорошая растворимость в воде, поэтому доступных качественных реакций на ионы этих элементов нет. Наличие в соединении даже ничтожно малого количества ионов натрия или калия определяют путем внесения этого соединения в бесцветное пламя: в случае натрия пламя окрашивается в желтый цвет, а в случае калия – в розово-фиолетовый. Натрий и калий образует средние, кислые, двойные и комплексные соли. Большинство средних солей натрия и калия – термически устойчивые вещества и разлагаются только при очень высоких температурах. При умеренном нагревании разлагаются только соли галогенсодержащих оксокислот, нитраты и некоторые другие соединения:

Кислые соли менее устойчивы, при нагревании все они разлагаются:

Основных солей эти элементы не образуют.
Из солей наибольшее значение имеет хлорид натрия – NaCl – поваренная соль. Это необходимая составная часть пищи, консервант, сырье для химической промышленности. Из него получают гидроксид натрия, питьевую соду (NaHCO3), соду (Na2CO3) и многие другие соединения натрия. Многие соли натрия образуют кристаллогидраты. Na2S2O3?Н2О – тиосульфат натрия, соответствующий тиосерной кислоте Н2S2O3, применяется в фотографии, для фиксации проявленных бумаг. Na2SO4?10H2O – десятиводный сульфат натрия, глауберова соль, используется в сульфатном способе получения соды и в производстве стекла. Na2CO3?10H2O – карбонат натрия или кальцинированная сода применяется в стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтяной, химической промышленностях, а также в быту. NaNO3 – нитрат натрия, натриевая или чилийская селитра – используется как минеральное удобрение. Соли калия – необходимые минеральные удобрения. Na2SiO3 – силикат натрия – используется в производстве стекла. Соли калия выделяются из раствора в основном без кристаллизационной воды. К2CO3 – карбонат калия или поташ – используется в производстве мыла, в производстве тугоплавкого стекла, в фотографии. КNO3 – карбонат калия или калиевая селитра – применяется при изготовлении черного пороха. КCl – хлорид калия – применяется в качестве удобрения. Многие соли калия встречаются в природе: КCl?MgCl?6Н2О – карналлит; КCl?NaCl – сильвинит. Соли К содержатся в квасцах.
Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкийщелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, вморской воде, а также во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих свойствах калий очень близок натрию, но с точки зрения биологической функции и использования клетками живых организмов они антагонистичны.
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn,Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами [править | править вики-текст]
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие отлития и натрия). При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):

с халькогенами (100—200 °C, E = S, Se, Te):

При сгорании калия на воздухе образуется надпероксид калия KO2 (с примесью K2O2):

В реакции с фосфором в инертной атмосфере образуется фосфид зелёного цвета (200 °C):

Взаимодействие со сложными веществами [править | править вики-текст]
Калий при комнатной температуре активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора.



Калий глубоко восстанавливает разбавленные серную и азотную кислоты:

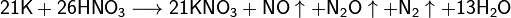
При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
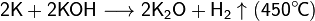
При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (65—105 °C):
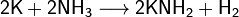
Металлический калий реагирует со спиртами с образованием алкоголятов:

Алкоголяты щелочных металлов (в данном случае − этанолат калия) являются очень сильными основаниями и широко используются в органическом синтезе.
Соединения с кислородом [править | править вики-текст]
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:

Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:

Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:

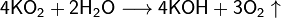

Советский изолирующий противогаз ИП-5
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше 20 °C:

Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при 50 °C:

Гидроксид [править | править вики-текст]
Основная статья: Гидроксид калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при 20 °C в 100 г воды составляет 112 г.
Роль калия в организме:
1. Регулирует кислотно - щелочное равновесие крови, водный баланс межклеточной и клеточной жидкости, водно-солевой баланс, осмотическое давление.
2. Принимает участие в передаче нервных импульсов.
3. Активизирует работу некоторых ферментов, углеводный и белковый обмен.
4. Требуется для синтеза белка, преобразования глюкозы в гликоген.
5. Необходим для осуществления выделительной функции почек.
6. Улучшает деятельность кишечника.
7. Поддерживает нормальный уровень кровяного давления, принимает участие в нервной регуляции сердечных сокращений.
Вопрос
Ма́гний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета.
Магний — металл серебристо-белого цвета с гексагональной решёткой, обладает металлическим блеском; пространственная группа P 63/ mmc, параметры решётки a = 0,32029 нм, c = 0,52000 нм, Z = 2. При обычных условиях поверхность магния покрыта прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2. Плотностьмагния при 20 °C — 1,738 г/см³, температура плавления металла tпл = 650 °C, температура кипения tкип = 1090 °C[2], теплопроводность при 20 °C — 156 Вт/(м·К).
Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида. При этом выделяется большое количество теплоты и световой энергии:


Магний может гореть даже в углекислом газе:

Раскаленный магний энергично реагирует с водой, вследствие чего горящий магний нельзя тушить водой:
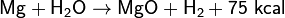
Возможна также реакция:
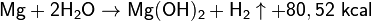
Щелочи на магний не действуют, в кислотах он растворяется с бурным выделением водорода:

Магний со взрывом реагирует с сильными окислителями типа порошкового перманганата калия.
Магний в организме:
Метаболизм: макроэлемент принимает участие в более чем 300 ферментативных реакциях, в том числе, с участием молекулы, оберегающей энергию - аденозинтрифосфата, АДФ. Наиболее активно в тех, которые относятся к утилизации энергии. А также магний нужен для выработки белка, ДНК, для расщепления глюкозы, выведения из организма токсинов, для усвоения витамина С, тиамина (В1) и пиридоксина (В6). Магний способствует устойчивости структуры клетки в процессе роста, принимает участие в процессе регенерации клеток организма.
Взаимодействие с кальцием: магний, взаимодействуя с кальцием, участвует в различных процессах - в регулировании тонуса кровеносных сосудов, в сокращении мышц. Кальций нужен для сокращения гладких мышц кровеносных сосудов, магний же для расслабления мускулатуры и расширения артерий.
Магний может воздействовать на уровень кальция, оказывая влияние на гормоны, которые управляют усвоением и обменом кальция, а также влиять на клеточном уровне – на распространение кальция в организме. Оптимальный пищевой рацион предполагает соотношение кальция и магния как 2:1.
Перемещение ионов: магний способствует поддержанию электрического потенциала мембран, проникновению через них ионов кальция, натрия, калия. Также он принимает участие в передаче нервных импульсов.
Действие инсулина: активно взаимодействуя с инсулином, способен повышать его секрецию и улучшать проникновение в клетки.
Польза магния:
· благотворно влияет на рост костей;
· координирует сердечный ритм, снижает повышенное артериальное давление;
· регулирует уровень сахара в крови;
· способствует улучшению функции дыхания при хронической астме, эмфиземе, бронхитах;
· представляет собой профилактическое средство против мышечных и суставных болей, синдрома хронической усталости, мигрени;
· нормализует состояние при предменструальном синдроме;
· снижает негативные эффекты радиотерапии и химиотерапии;
· способствует здоровью зубов, укрепляет эмаль;
· предотвращает отложения кальция, камней в желчном пузыре и почках.
Ка́льций — элемент главной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 20. Обозначается символом Ca (лат. Calcium). Простое вещество кальций (CAS-номер: 7440-70-2) — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета.
Металл кальций существует в двух аллотропных модификациях. До 443 °C устойчив α-Ca с кубической гранецентрированной решеткой (параметр а = 0,558 нм), выше устойчив β-Ca с кубической объемно-центрированной решеткой типа α-Fe (параметр a = 0,448 нм). Стандартная энтальпия  перехода α → β составляет0,93 кДж/моль.
перехода α → β составляет0,93 кДж/моль.
При постепенном повышении давления начинает проявлять свойства полупроводника, но не становится полупроводником в полном смысле этого слова (металлом уже тоже не является). При дальнейшем повышении давления возвращается в металлическое состояние и начинает проявлять сверхпроводящие свойства (температура сверхпроводимости в шесть раз выше, чем у ртути, и намного превосходит по проводимости все остальные элементы). Уникальное поведение кальция похоже во многом на стронций (то есть параллели в периодической системе сохраняются)[8].
Кальций — типичный щёлочноземельный металл. Химическая активность кальция высока, но ниже, чем более тяжёлых щёлочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло-серая, поэтому в лаборатории кальций обычно хранят, как и другие щёлочноземельные металлы, в плотно закрытой банке под слоем керосина или жидкого парафина.
В ряду стандартных потенциалов кальций расположен слева от водорода. Стандартный электродный потенциал пары Ca2+/Ca0 −2,84 В, так что кальций активно реагирует с водой, но без воспламенения:

С активными неметаллами (кислородом, хлором, бромом, иодом) кальций реагирует при обычных условиях:


При нагревании на воздухе или в кислороде кальций воспламеняется и горит красным пламенем с оранжевым оттенком («кирпично-красным»). С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например:
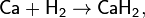
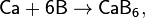

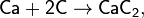


Кроме получающихся в этих реакциях фосфида кальция Ca3P2 и силицида кальция Ca2Si, известны также фосфиды кальция составов СаР и СаР5 и силициды кальция составов CaSi, Ca3Si4 и CaSi2.
Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты. Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например:


Ион Ca2+ бесцветен. При внесении в пламя растворимых солей кальция пламя окрашивается в кирпично-красный цвет.
Такие соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3,сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.
Важное значение имеет то обстоятельство, что, в отличие от карбоната кальция СаСО3, кислый карбонат кальция (гидрокарбонат) Са(НСО3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает наизвестняки, то наблюдается их растворение, а тех же местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция

Так в природе происходит перенос больших масс веществ. В результате под землей могут образоваться огромные карстовые полости и провалы, а в пещерах образуются красивые каменные «сосульки» — сталактиты и сталагмиты.
Наличие в воде растворенного гидрокарбоната кальция во многом определяет вре́менную жёсткость воды. Вре́менной её называют потому, что при кипячении воды гидрокарбонат разлагается, и в осадок выпадает СаСО3. Это явление приводит, например, к тому, что в чайнике со временем образуется накипь.
Кальций в организме:
1. Зубы и кости: главная функция макроэлемента – функция структурного материала, создание и поддержание полноценных зубов и костей. В составе костной ткани кальций содержится в двух формах: свободной и связанной. Если резервыминерального вещества в свободной форме истощены, извлекается кальций из костей для поддержания его уровня в крови. Каждый год на 20% происходит обновление костей в организме взрослого человека.
2. Сокращение мышечной ткани: кальций оказывает влияние на сокращения мышц и, действуя на сердечную мышцу, координирует сердцебиение.
3. ЦНС: требуется для передачи нервных импульсов, активизируя действие ферментов, принимающих участие в синтезе нейромедиаторов.
4. Сердечно-сосудистая система: вместе с магнием, калием, натрием кальций регулирует давление крови.
5. Система крови: усиливает действие витамина K (протромбин), являющегося основным фактором нормальной свертываемости крови.
6. Клеточные мембраны: кальций воздействует на проницаемость мембран, требуется для транспортировки питательных веществ и иных соединений сквозь клеточные мембраны, а также с целью укрепления соединительных тканей клеток.
7. Иные функции: способствует укреплению иммунной системы, синтезу и активации многих ферментов и гормонов (оказывает десенсибилизирующее и противовоспалительное действие на функцию эндокринных желез), которые принимают участие в переваривании пищи, синтезе слюны, жировом обмене и метаболизме энергии.
Итак, роль кальция в организме: координация проницаемости клеточных мембран, внутриклеточных процессов, нервной проводимости, сокращений мышц, поддержание работы сердечно-сосудистой системы, формирование костей и минерализация зубов, участие в важнейшем этапе работы системы гемостаза - свертывании крови.
Хлорофи́лл (от греч. χλωρός, «зелёный» и φύλλον, «лист») — зелёный пигмент, окрашивающий хлоропласты растений в зелёный цвет. При его участии осуществляется процесс фотосинтеза. По химическому строению хлорофиллы — магниевые комплексыразличных тетрапирролов. Хлорофиллы имеют порфириновое строение и структурно близки гему.
Хлорофиллы можно рассматривать как производные протопорфирина — порфирина с двумя карбоксильными заместителями(свободными или этерифицированными). Так, хлорофилл a имеет карбоксиметиловую группу при С10, фитоловый эфирпропионовой кислоты — при С7. Удаление магния, легко достигаемое мягкой кислотной обработкой, дает продукт, известный какфеофитин. Гидролиз фитоловой эфирной связи хлорофилла приводит к образованию хлорофиллида (хлорофиллид, лишенный атома металла, известен как феофорбидa).
Все эти соединения интенсивно окрашены и сильно флуоресцируют, исключая те случаи, когда они растворены в органических растворителях в строго безводных условиях. Они имеют характерные спектры поглощения, пригодные для качественного и количественного определения состава пигментов. Для этой же цели часто используются также данные о растворимости этих соединений в соляной кислоте, в частности для определения наличия или отсутствия этерифицированных спиртов.Хлороводородное число определяется как концентрация HCl (%, масс./об.), при которой из равного объема эфирного раствора пигмента экстрагируется 2/3 общего количества пигмента. «Фазовый тест» — окрашивание зоны раздела фаз — проводят, подслаивая под эфирный раствор хлорофилла равный объем 30%-ного раствора KOH в MeOH. В интерфазе должно образовываться окрашенное кольцо. С помощью тонкослойной хроматографии можно быстро определять хлорофиллы в сырых экстрактах.
Хлорофиллы неустойчивы на свету; они могут окисляться до алломерных хлорофиллов на воздухе в метанольном или этанольном растворе.
Хлорофиллы образуют комплексы с белками in vivo и могут быть выделены в таком виде. В составе комплексов их спектры поглощения значительно отличаются от спектров свободных хлорофиллов в органических растворителях.
Хлорофиллы можно получить в виде кристаллов. Добавление H2O или Ca2+ к органическому растворителю способствует кристаллизации.
Вопрос
Так как кальций широко распространен в природе, его соли в большом количестве содержатся в природных водах. Вода, имеющая в своем составе соли магния и кальция, называется жесткой водой. Если соли присутствуют в воде в небольших количествах или отсутствуют, то вода называется мягкой. В жесткой воде мыло плохо пенится, поскольку соли кальция и магния образуют с ним нерастворимые соединения. В ней плохо развариваются пищевые продукты. При кипячении на стенках паровых котлов образуется накипь, которая плохо проводит теп-лоту, вызывает увеличение расхода топлива и изнашивание стенок котла. Жесткой водой нельзя пользоваться, проводя ряд технологических процессов (крашение). Образование накипи: Са + 2НСО3 = Н2О + СО2 + СаСО3?.
Перечисленные выше факторы указывают на необходимость удаления из воды солей кальция и магния. Процесс удаления этих солей называется водоумягчением, является одной из фаз обработки воды (водоподготовки).
Водоподготовка – обработка воды, используемая для различных бытовых и технологических процессов.
Жесткость воды подразделяется на:
1) карбонатную жесткость (временную), которая вызывается наличием гидрокарбонатов кальция и магния и устраняется с помощью кипячения;
2) некарбонатную жесткость (постоянную), которая вызывается присутствием в воде сульфитов и хлоридов кальция и магния, которые при кипячении не удаляются, поэтому она называется постоянной жесткостью.
Верна формула: Общая жесткость = Карбонатная жесткость + Некарбонатная жесткость.
Общую жесткость ликвидируют добавлением химических веществ или при помощи катиони-тов. Для полного устранения жесткости воду иной раз перегоняют.
При применении химического метода растворимые соли кальция и магния переводят в нерастворимые карбонаты:

Более модернизированный процесс устранения жесткости воды – при помощи катионитов.
Катиониты – сложные вещества (природные соединения кремния и алюминия, высокомолекулярные органические соединения), общая формула которых – Na2R, где R – сложный кислотный остаток.
При пропускании воды через слой катионита происходит обмен ионов (катионов) Na на ионы Са и Mg: Са + Na2R = 2Na + CaR.
Ионы Са из раствора переходят в катионит, а ионы Na переходят из катионита в раствор. Чтобы восстановить использованный катионит, его необходимо промыть раствором поваренной соли. При этом происходит обратный процесс: 2Na + 2Cl + CaR = Na2R + Ca + 2Cl.
Вопрос
Углерод — важнейший биогенный элемент, является структурной единицей органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, витамины, гормоны, медиаторы и другие). Содержание углерода в организме в расчете на сухое вещество составляет 45,4-46,5%. В процессе жизнедеятельности организмов происходит окислительный распад органических соединений с выделением во внешнюю среду CO2. Углекислый газ, растворенный в биологических жидкостях, участвует в поддержании оптимальной для жизнедеятельности кислотности среды.
При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—501 °C, 600—700 °C и 800—1000 °C.
Степени окисления +4 (напр., CO2), −4 (напр., CH4), редко +2 (СО, карбонилы металлов), +3 (C2N2); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С0 к С4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
 2018-01-21
2018-01-21 1252
1252
