Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
Оксид углерода(II) СО — бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, так как он очень ядовит. Попадая при дыхании в кровь, быстро соединяется с гемоглобином, образуя прочное соединение карбоксигемоглобин (объясните происхождение этого термина), лишая тем самым возможности гемоглобин переносить кислород. При вдыхании воздуха, содержащего 0,1% СО, человек может внезапно потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива (напишите уравнение соответствующей химической реакции), вот почему так опасно преждевременное закрывание дымоходов.
Оксид СО относят, как вы уже знаете, к несолеобразующим оксидам, так как, будучи оксидом неметалла, он должен реагировать со щелочами и основными оксидами, однако этого не наблюдается.
СО — хороший восстановитель (почему?). Он сгорает в кислороде, образуя углекислый газ:
2СО + 02 = 2С02
Оксид углерода(II) способен отнимать кислород у оксидов металлов, т. е. восстанавливать металлы из их оксидов:
Fе203 + ЗСО = 2Fе + ЗС02
Именно это свойство оксида углерода(II) используется в металлургии при выплавке чугуна.
Оксид углерода(IV) С02 — широко известный под названием углекислый газ — бесцветный, не имеющий запаха газ. Он примерно в полтора раза тяжелее воздуха. При обычных условиях в 1 объеме воды растворяется 1 объем углекислого газа.
При давлении примерно 60 атм углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твердую снегообразную массу, которую в промышленности прессуют, — это известный вам сухой лед, который применяется для хранения пищевых продуктов. Вы уже знаете, что твердый углекислый газ имеет молекулярную решетку, способен к возгонке (что это такое?).
С02 — это типичный кислотный оксид: взаимодействует со щелочами (например, вызывает помутнение известковой воды), с основными оксидами и водой.
Он не горит и не поддерживает горения (рис. 44) и потому применяется для тушения пожаров. Однако магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи:
С02 + 2Мg = 2МgO + С
Углекислый газ получают, действуя на соли угольной кислоты — карбонаты растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии на мел или мрамор соляной кислоты:
СаС03 + 2НСl = СаСl2 + Н20 + С02
В промышленности большие количества углекислого газа получают обжигом известняка:
СаС03 = СаО + СO2
(вспомните, производство какого продукта служит основной целью этой реакции).
Углекислый газ, кроме уже названной области применения, используют также для изготовления шипучих напитков и для получения соды.
При растворении оксида углерода(IV) в воде образуется угольная кислота Н2С03, которая очень нестойкая и легко разлагается на исходные компоненты — углекислый газ и воду:
CO2 + Н20 —> H2CO3
Равновесие этой реакции смещено влево.
Как двухосновная кислота она образует два ряда солей: средние — карбонаты и кислые — гидрокарбонаты. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Кислые соли, как правило, растворимы в воде.
При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Так, если через известковую воду пропускать углекислый газ, то она сначала помутнеет из-за выпавшего в осадок нерастворимого в воде карбоната кальция, однако при дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция:
СаС03 + Н20 + С02 = Са(НС03)2
Именно наличием этой соли и объясняется временная жесткость воды. Почему временная? Потому, что при нагревании растворимый гидрокарбонат кальция снова превращается в нерастворимый карбонат:
Са(НС03)2 = СаС03 + Н20 + С02
Эта реакция приводит к образованию накипи на стенках котлов, труб парового отопления и домашних чайников, а в природе в результате этой реакции формируются в пещерах свисающие вниз. Другие соли кальция и магния, в частности хлориды и сульфаты, придают воде постоянную жесткость. Кипячением постоянную жесткость воды устранить нельзя. Приходится использовать другой карбонат — соду Nа2С03, которая переводит
эти ионы Са2+ в осадок, например:
СаСl2 + Na2С03 = СаС034- + 2NаСl
Соду можно использовать и для устранения временной жесткости воды.
Карбонаты и гидрокарбонаты можно обнаружить с помощью растворов кислот: при действии на них кислот наблюдается характерное «вскипание» из-за выделяющегося углекислого газа:
CO + 2Н+ = Н20 + С02 НС03 + Н+ = Н20 + С02
Эта реакция является качественной реакцией на соли угольной кислоты.
Вопрос
Азо́т — элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) второго периода периодической системы химических элементов Д. И. Менделеева, сатомным номером 7. Относится к пниктогенам. Обозначается символом N (лат. Nitrogenium).Простое вещество азот — двухатомный газ без цвета, вкуса и запаха. Один из самых распространённых элементов на Земле. Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09 % объёма), разделением которого получают промышленный азот, (более ¾ идёт на синтез аммиака). Применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент. Азот — один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот[4].
Азот в свободном состоянии существует в форме двухатомных молекул N2, электронная конфигурация которых описывается формулой σs²σs*2πx, y4σz², что соответствует тройной связи между атомами азота N≡N (длина связи dN≡N = 0,1095 нм). Вследствие этого молекула азота крайне прочна, для реакции диссоциации N2↔ 2N изменение энтальпии в реакции ΔH°298=945 кДж/моль[10], константа скорости реакции К298=10−120, то есть диссоциация молекул азота при нормальных условиях практически не происходит (равновесие практически полностью сдвинуто влево). Молекула азота неполярна и слабо поляризуется, силы взаимодействия между молекулами очень слабые, поэтому в обычных условиях азот газообразен.
Даже при 3000 °C степень термической диссоциации N2 составляет всего 0,1 %, и лишь при температуре около 5000 °C достигает нескольких процентов (при нормальном давлении). В высоких слоях атмосферы происходит фотохимическая диссоциация молекул N2. В лабораторных условиях можно получить атомарный азот, пропуская газообразный N2 при сильном разрежении через поле высокочастотного электрического разряда. Атомарный азот намного активнее молекулярного: в частности, при обычной температуре он реагирует с серой, фосфором, мышьяком и с рядом металлов, например, со ртутью.
Вследствие большой прочности молекулы азота некоторые его соединения эндотермичны (многие галогениды, азиды, оксиды), то есть энтальпия их образования положительна, а соединения азота термически малоустойчивы и довольно легко разлагаются при нагревании. Именно поэтому азот на Земле находится по большей части в свободном состоянии.
Ввиду своей значительной инертности азот при обычных условиях реагирует только с литием:
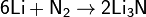
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:

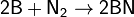
Наибольшее практическое значение имеет нитрид водорода (аммиак) NH3, получаемый взаимодействием водорода с азотом (см. ниже).
В электрическом разряде реагирует с кислородом, образуя оксид азота(II) NO.
Описано несколько десятков комплексов с молекулярным азотом.
Промышленное связывание атмосферного азота[править | править вики-текст]
Соединения азота чрезвычайно широко используются в химии, невозможно даже перечислить все области, где находят применение вещества, содержащие азот: это индустрия удобрений, взрывчатых веществ, красителей, медикаментов и проч. Хотя колоссальные количества азота доступны в прямом смысле слова «из воздуха», из-за описанной выше прочности молекулы азота N2 долгое время оставалась нерешённой задача получения соединений, содержащих азот, из воздуха; большая часть соединений азота добывалась из его минералов, таких, как чилийская селитра. Однако сокращение запасов этих полезных ископаемых, а также рост потребности в соединениях азота заставил форсировать работы по промышленному связыванию атмосферного азота.
Наиболее распространён аммиачный способ связывания атмосферного азота. Обратимая реакция синтеза аммиака:
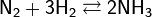
экзотермическая (тепловой эффект 92 кДж) и идёт с уменьшением объёма, поэтому для сдвига равновесия вправо в соответствии с принципом Ле Шателье — Браунанеобходимо охлаждение смеси и высокие давления. Однако с кинетической точки зрения снижение температуры невыгодно, так как при этом сильно снижаетсяскорость реакции — уже при 700 °C скорость реакции слишком мала для её практического использования.
В таких случаях используется катализ, так как подходящий катализатор позволяет увеличить скорость реакции без сдвига равновесия. В процессе поиска подходящего катализатора было испробовано около двадцати тысяч различных соединений. По совокупности свойств (каталитическая активность, стойкость к отравлению, дешевизна) наибольшее применение получил катализатор на основе металлического железа с примесями оксидов алюминия и калия. Процесс ведут при температуре 400—600 °C и давлениях 10—1000 атмосфер.
Следует отметить, что при давлениях выше 2000 атмосфер синтез аммиака из смеси водорода и азота идёт с высокой скоростью и без катализатора. Например, при 850 °C и 4500 атмосфер выход продукта составляет 97 %.
Существует и ещё один, менее распространённый способ промышленного связывания атмосферного азота — цианамидный метод, основанный на реакции карбида кальция с азотом при 1000 °C. Реакция происходит по уравнению:
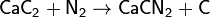
Реакция экзотермична, её тепловой эффект 293 кДж.
Ежегодно из атмосферы Земли промышленным путём отбирается примерно 1·106 т азота.
Водородные соединения азота проявляют сильные восстановительные свойства за счет атомов азота в отрицательных степенях окисления. Гидразин и гидроксиламин под действием сильных восстановителей могут переходить в аммиак или катион аммония и, таким образом, служить слабыми окислителями. Аммиак проявляет окислительные свойства только за счет атомов водорода в реакциях с активными металлами. При этом образуются амиды (NaNH2) и выделяется водород.
Водородные соединения азота и их производные.
Водородное соединение азота - аммиак NHj; взаимодействие с Н20 протекает незначительно, так как знаки эффективных зарядов Н в NHj и Н2О совпадают.
Водородные соединения азота, как правило, проявляют сильные восстановительные свойства за счет атома азота в отрицательных степенях окисления.
Летучим характеристическим водородным соединением азота, по Менделееву, является аммиак.
Летучим характеристическим водородным соединением азота является аммиак.
Какиеводородные соединения азота известны.
Изводородных соединений азота наибольшее значение имеет аммиак - бесцветный газ с характерным запахом; он легче воздуха, очень хорошо растворяется в воде.
Химияводородных соединений азота во многих отношениях похожа на химию соединений кислорода, являющихся производными воды.
Изводородных соединений азота в анализе имеет наибольшее значение аммиак NH3 и комплексный катион NH4, из кислородных - азотная и азотистая кислоты. Реакции иона NH4 рассмотрены выше (см. стр.
Какие свойстваводородных соединений азота проявляются в этих реакциях.
Летучим характеристичес-имводородным соединением азота является аммиак.
В кислородных соединениях азот проявляет степень окисления от +1 до +5.
N2O; NO; N2O3; NO2; N2O4; N2O5
Оксиды N2O и NO – несолеобразующие, остальные солеобразующие.
Оксид азота (I) и оксид азота (II) – бесцветные газы, оксид азота (III) – синяя жидкость, (IV) – бурый газ, (V) – прозрачные бесцветные кристаллы.
Кроме N2O, все они чрезвычайно ядовиты. Закись азота N2O обладает весьма своеобразным физиологическим действием, за которые ее часто называют веселящим газом. Вот как описывают действия закиси азота английский химик Хэмфри Дэви, который с помощью этого газа устраивал специальные сеансы: «Одни джентльмены прыгали по столам и стульям, у других развязывались языки, третьи обнаружили чрезвычайную склонность к потасовке». Вдыхание N2O вызывает потерю болевых ощущений и поэтому применяется в медицине как анестезирующее средство.
Склонность NO2 к димеризации – следствие нечетного числа электронов в молекуле (парамагнитна).
С оксидами азота связаны серьезные экологические проблемы. Увеличение их концентрации в атмосфере приводит к образованию азотной кислоты и соответсвенно кислотных дождей.
N2O3 взаимодействует с водой, образует неустойчивую азотистую кислоту HNO2, которая существует только в разбавленных растворах, так как легко разлагается
2HNO2 = N2O3 + H2O.
Ее соли нитриты – устойчивы. HNO2 - кислота средней силы. Наряду с кислотной диссоциацией в незначительной степени идет диссоциация с образованием NO+ и OH–.
Степень окисления азота в нитритах промежуточная (+3), поэтому в реакциях он может вести себя и как окислитель, и как восстановитель, т.е. обладает окислительно-восстановительной двойственностью.
Сильные окислители переводят NO2– в NO3–.
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
Сильные восстановители обычно восстанавливают HNO2 до NO.
2NaNO2 + 2KI + 2H2SO4 = Na2SO4 +2NO + I2 + K2SO4 +2H2O
Может происходить также процесс диспропорционирования, одновременного увеличения и уменьшения степени окисления атомов одного и того же элемента.
3HNO2 = HNO3 + 2NO + H2O
Нитриты обладают токсичностью: переводят гемоглобин в метгемоглобин, не способный переносить кислород и они служат причиной образования в продуктах питания нитрозааминов R2N–NO – канцерогенных веществ.
 2018-01-21
2018-01-21 617
617








