Углерод реагирует со многими элементами. Соединения с неметаллами имеют свои собственные названия — метан, тетрафторметан.
Продуктами горения углерода являются CO и CO2 (монооксид углерода и диоксид углерода соответственно). Известен также неустойчивый недооксид углерода С3О2(температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например, C12O9, C5O2, C12O12). Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C.
Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты. На Земле наиболее широко распространеныкарбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит).
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольнымиэлектродами в атмосфере азота образуется циан. При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту:
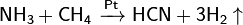
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. Получен селенид углерода CSe2. С большинством металлов углерод образуеткарбиды, например:
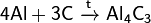
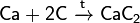
Важна в промышленности реакция углерода с водяным паром:
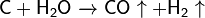
При нагревании углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности.
 2018-01-21
2018-01-21 366
366








