В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.
Первичная диссоциация комплексного соединения - это его распад на комплексный ион, образованный внутренней сферой и ионы внешней сферы. В водных растворах первичная диссоциация комплексных соединений обусловлена разрывом ионной связи между внутренней и внешней сферами, она практически необратима:
K3[Fe(CN)6] ® 3K+ + [Fe(CN)6]3–
Na[Al(OH)4] ® Na+ + [Al(OH)4]–
[Cu(NH3)4]SO4 ® [Cu(NH3)4]2+ + SO42–
[Pt(NH3)4Cl2]Cl2 ® [Pt(NH3)4Cl2]2+ + 2Cl–
Образующийся комплексный ион ведет себя как целая самостоятельная частица с характерными для нее свойствами. Поэтому в водных растворах комплексных соединений, как правило, нельзя обнаружить присутствие ионов или молекул, входящих в состав внутренней сферы. В растворе красной кровяной соли нельзя обнаружить присутствие ионов Fe3+ и CN–, а в 1М растворе хлорида дихлоротетраамминплатины(IV) [Pt(NH3)4Cl2]Cl2 обнаруживается только присутствие 2 моль хлорид-ионов, а не 4 моль.
Но насколько устойчива внутренняя сфера комплекса? Может ли происходить отщепление лигандов от комплексообразователя? Действительно, это возможный процесс, он называется вторичной диссоциацией комплексного соединения.
Вторичная диссоциация комплексного соединения – это распад внутренней сферы комплекса на составляющие ее компоненты.
Так как при этом разрушаются не ионные, а ковалентные связи комплексообразователя с лигандами, этот процесс затруднен и обратим. Он происходит ступенчато:
[Ag(NH3)2]+? [Ag(NH3)]+ + NH3 1-ая ступень
[Ag(NH3)]+? Ag+ + NH3 2-ая ступень
Вторичная диссоциация характеризуется константой равновесия, причем для каждой из стадий можно вычислить свою константу. Для количественной оценки устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию. Эту константу называют константой нестойкости комплекса Кнест. В соответствии с законом действующих масс для приведенного нами выше примера диссоциации иона диамминсеребра выражение для константы нестойкости принимает вид:
Чем ниже Kнест, тем прочнее и стабильнее внутренняя сфера комплексного соединения, тем в меньшей мере происходит вторичная диссоциация комплексного соединения в растворе.65
Вопрос
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх[11]. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·106Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твёрдый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм.
В 1935 году Уингер и Хунтингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлегкий металл, компонент легкого и энергоёмкого ракетного топлива. Сейчас (2014 г.) установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл[12].
Молекулярный водород существует в двух спиновых формах (модификациях) — в виде орто- и пара водорода. В молекуле ортоводорода o -H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p -H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o -H2 и p -H2 при заданной температуре называется равновесный водород e -H2.
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесная смесь (орто-пара 75:25). Без катализатора превращение происходит медленно, что даёт возможность изучить свойства обеих модификаций. В условиях межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Доля диссоциировавших молекул водорода
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
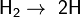 - 432 кДж
- 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
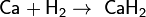
и с единственным неметаллом — фтором, образуя фтороводород:
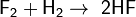
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении:
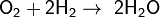
Он может «отнимать» кислород от некоторых оксидов, например:
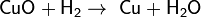
Записанное уравнение отражает восстановительные свойства водорода.
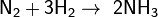
С галогенами образует галогеноводороды:
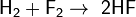 , реакция протекает со взрывом в темноте и при любой температуре,
, реакция протекает со взрывом в темноте и при любой температуре,
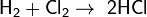 , реакция протекает со взрывом, только на свету.
, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
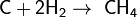
Взаимодействие со щелочными и щёлочноземельными металлами[править | править вики-текст]
При взаимодействии с активными металлами водород образует гидриды:
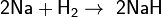
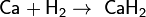
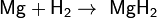
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
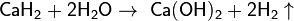
Взаимодействие с оксидами металлов (как правило, d-элементов)[править | править вики-текст]
Оксиды восстанавливаются до металлов:
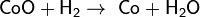
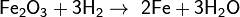
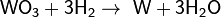
Гидрирование органических соединений[править | править вики-текст]
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр., Катализатор Уилкинсона), так и гетерогенным (напр., никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких, как алкены и алкины, образуются насыщенные соединения — алканы.
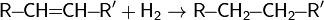
Вопрос
Вода – наиболее широко распространённое соединение на нашей планете. Она покрывает 4/5 всей поверхности Земли. Это единственное уникальное соединение, которое может быть в 3х различных агрегатных состояниях: лед, вода и пар.
Вода играет важнейшую роль не только в промышленности, но и в жизни каждого человека. Известно, что без пищи человек может прожить месяц, а без воды не проживет и недели.
Чистой воды в природе не существует, всегда есть примеси. Для очистки от этих загрязнений используют процесс дистилляции, отгонки, поэтому часто можно встретить фразу «дистиллированная вода»,
Вода не обладает запахом, цветом и вкусом.
 2018-01-21
2018-01-21 9623
9623
