Каталитическими называются реакции, протекающие с участием катализатора.
Катализаторы – вещества, которые не входят в состав конечных продуктов реакции. Вступают в катализ с химическими участниками реакции, образуя промежуточные вещества.
Различают положительный катализ (наличие катализатора ускоряет реакцию) и отрицательный (происходит замедление реакции или ингибирование).
В некоторых случаях катализатор могут быть один из участников реакции – автокаталитические реакции:

Все виды катализа можно разделить на:
 гомогенный - катализатор и другие реагирующие вещества находятся в одной фазе:
гомогенный - катализатор и другие реагирующие вещества находятся в одной фазе:

 гетерогенный – катализаторы и реагирующие вещества находятся в различных фазах, а химическое превращение протекает на поверхности катализа.
гетерогенный – катализаторы и реагирующие вещества находятся в различных фазах, а химическое превращение протекает на поверхности катализа.

Особенности протекания:
Ø К. не влияет на термодинамическое равновесие, он изменяет лишь скорость;
Ø Действие катализатора является специфичным, т.е. К. влияет лишь на стадию;
Ø Действие катализатора селективно;
|
|
|
Ø Необходимо малое количество катализатора;
Ø Скорость реакции пропорционально концентрации катализатора;
Ø Действие К. зависит от его физического состояния и от присутствия посторонних вещей.
Ø Смесь К. действует сильнее.
Гомогенный катализ.
К гомогенным каталитическим реакциям относятся реакции, протекающие в газовой фазе или в растворе.
Основные положения теории:
ü В результате реакции происходит образование неустойчивых промежуточных соединений, в состав которых входит катализатор и реагирующее вещество;
ü Расход в результате реакции промежуточных соединений;
ü Регенерация катализатора;

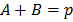
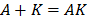

а. Если промежуточное соединение находится в равновесии с исходными веществами, то их называют веществами Аррениуса.


 – константы скорости образования, разложения соединения и образования продуктов реакции соответственно.
– константы скорости образования, разложения соединения и образования продуктов реакции соответственно.


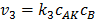
 – аналитическая концентрация катализатора;
– аналитическая концентрация катализатора;
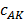 - концентрация промежуточного соединения;
- концентрация промежуточного соединения;
Приравняв  , и выразив, подставим полученное в уравнение 3:
, и выразив, подставим полученное в уравнение 3:

1) 
2) 
В обоих случаях скорость прямо пропорциональна концентрации катализатора. Порядок реакции будет колебаться от 1 до 2.
б. Если полученные вещества не находятся в равновесии с исходными веществами, их называют вещества Вант Гоффа, при этом  .
.



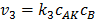
Приравняв  , и выразив, подставим полученное в уравнение 3:
, и выразив, подставим полученное в уравнение 3:

1) 
2) 
Предельные случаи всегда соответствуют реакциям 1-го порядка: в первом случаи по А, а во втором – по В. Скорость реакции пропорционально концентрации катализатора.
 2018-01-21
2018-01-21 491
491








