Диокси́д углеро́да (углеки́слый газ) — бесцветный газ, без запаха, со слегка кисловатым вкусом.
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов.
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов. Смесь полученных газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту.
У́гольная кислота́ — слабая двухосновная кислота с химической формулой H2CO3, образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. В водных растворах неустойчива. Образует ряд устойчивых неорганических и..органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Угольная кислота образуется при растворении в воде диоксида углерода:

Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
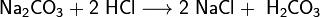

Будучи двухосновной, угольная кислота образует два ряда солей: средние соли (карбонаты) и кислые (гидрокарбонаты). Большинство солей угольной кислоты бесцветны. Из карбонатов растворимы в воде лишь соли щелочных металлов и аммония.
В воде карбонаты подвергаются гидролизу, и поэтому их растворы имеют щелочную реакцию:
Na2CO3 + H2O ↔ NaHCO3 + NaOH.
Дальнейший гидролиз с образованием угольной кислоты в обычных условиях практически не идет.
Растворение в воде гидрокарбонатов также сопровождается гидролизом, но в значительно меньшей степени, и среда создается слабощелочная (рН ≈ 8).
Сильные кислоты и даже слабая уксусная кислота вытесняют из карбонатов угольную кислоту:
K2CO3 + H2SO4 = K2SO4 + H2O + CO2↑.
В отличие от большинства карбонатов, все гидрокарбонаты в воде растворимы. Они менее устойчивы, чем карбонаты тех же металлов и при нагревании легко разлагаются, превращаясь в соответствующие карбонаты:
2KHCO3 = K2CO3 + H2O + CO2↑;
Ca(HCO3)2 = CaCO3 + H2O + CO2↑.
Сильными кислотами гидрокарбонаты разлагаются, как и карбонаты:
KHCO3 + H2SO4 = KHSO4 + H2O + CO2
Основные соли угольной кислоты в воде практически нерастворимы и при нагревании легко разлагаются:
(CuOH)2CO3 = 2CuO + CO2 + H2O.
 2018-01-21
2018-01-21 1449
1449
