Герма́ний Ge — химический элемент 14-й группы 4 периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 32.
Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида GeO2, который восстанавливают водородом при 600 °C до простого вещества:

Германий — хрупкий, серебристо-белый полуметалл. Кристаллическая решётка модификации — кубическая типа алмаза. Температура кипения 2850 °C, температура плавления 938,25 °C, плотность германия 5,33 г/см3. Германий является одним из немногих аномальных веществ, которые увеличивают плотность при плавлении. Германий по электрофизическим свойствам является не прямозонным полупроводником.
В химических соединениях германий обычно проявляет валентности 4 или 2.. При нормальных условиях устойчив к действию воздуха и воды, щелочей и кислот, растворим в царской водке и в щелочном растворе перекиси водорода.
О́лово (Sn) — элемент 14-й группы периодической таблицы химических элементов, пятого периода, с номером 50. Относится к группе лёгких металлов. Олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета.
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Простое вещество олово полиморфно. Олово существует в трех аллотропных модификациях. Серое олово (α-Sn) мелкокристаллический порошок, полупроводник, имеющий алмазоподобную кристаллическую решётку, существует при температуре ниже 13,2 °С. Белое олово (β-Sn) — пластичный серебристый металл, устойчивый в интервале температур 13,2—161 °С. Высокотемпературное гамма-олово (γ-Sn), имеющее ромбическую структуру, отличается высокой плотностью и хрупкостью, устойчиво между 161 и 232 °С (температура плавления чистого олова).
При комнатной температуре олово устойчиво к воздействию воздуха или воды. При нагревании олово реагирует с большинством неметаллов. В разбавленной серной кислоте олово не растворяется, а с концентрированной — реагирует очень медленно.
В концентрированной азотной кислоте образуется оловянная кислота. При этом олово ведет себя как неметалл. При взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. При нагревании олово, подобно свинцу, может реагировать с водными растворами щелочей.
Гидрид олова — станнан SnH4 — можно получить по реакции:

Олову отвечают два оксида SnO2 и SnO.
При хранении на воздухе монооксид SnO постепенно окисляется.
Свине́ц (Pb) — элемент 14-й группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82 и, таким образом, содержит магическое число протонов. Простое вещество свинец — ковкий, сравнительно легкоплавкий металл серебристо-белого цвета с синеватым отливом.
Для получения свинца в основном используют руды, содержащие галенит. Сначала методом флотации получают концентрат, содержащий 40—70 процентов свинца. Затем метод шахтной восстановительной плавки или метод кислородно-взвешенной циклонной электротермической плавки свинцово-цинковых продуктов.
Свинец имеет довольно низкую теплопроводность. Металл мягкий, режется ножом, легко царапается ногтем. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет. Относится к группе тяжёлых металлов.
На внешней электронной оболочке находятся 4 не спаренных электрона (2 на p- и 2 на d-подуровнях), поэтому основные степени окисления атома свинца — +2 и +4.
· Соли двухвалентного свинца реагируют с щелочами, образуя почти нерастворимый гидроксид свинца:
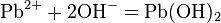
· При избытке щёлочи гидроксид растворяется:

· Реагирует со щелочами и кислотами:


Свинец образует комплексные соединения с координационным числом 4, например, 
 2018-01-21
2018-01-21 6820
6820
