Кислотные оксиды
1. Кислотный оксид + вода = кислота (исключение - SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4
2. Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O
3. Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
1. Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH
2. Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
3. Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
Амфотерные оксиды
1. Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O
2. Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O
(Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O
(Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4])
3. Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3
4. Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)3
Кислоты
1. Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O
2. Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O
|
|
|
3. Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O
4. Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O
5. Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3
6. Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб.) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
1. Амфотерный гидроксид + кислота = соль + вода
2. Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O
2. Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
3. Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
1. Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O
2. Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
3. Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4])
4. Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4]
5. Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl
6. Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
1. Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3)
2. Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl
3. Растворимая соль + щелочь = соль + нерастворимое основание
|
|
|
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3
4. Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Пример 1 Гидроксид цинка может реагировать с каждым веществом в паре:
1) сульфат кальция, оксид серы (VI);
2) гидроксид натрия (р-р), соляная кислота;
3) вода, хлорид натрия;
4) сульфат бария, гидроксид железа (III).
Решение - 2) Гидроксид цинка - амфотерный. Он реагирует как с кислотами, так и со щелочами.
Пример 2 Раствор сульфата меди(II) реагирует с каждым из двух веществ:
1) HCl и H2SiO3;
2) H2O и Cu(OH)2;
3) O2 и HNO3;
4) NaOH и BaCl2.
Решение - 4) В растворах реакция протекает, если выполняются условия: выпадает осадок, выделяется газ, образуется малодиссоциирующее вещество, например, вода.
Пример 3 Схема превращений Э -> Э2О3 -> Э(ОН)3 соответствует генетическому ряду:
1) натрий -> оксид натрия -> гидроксид натрия;
2) алюминий -> оксид алюминия -> гидроксид алюминия;
3) кальций -> оксид кальция -> гидроксид кальция;
4) азот -> оксид азота(V) -> азотная кислота.
Решение - 2) По схеме можно выяснить, что элементом является трёхвалентный металл, который образует соответствующие оксид и гидроксид.
Пример 4 Как осуществить следующие превращения:
Ca → Ca(OH)2 → CaCO3 → CaO → CaSO4 → CaCl2 → Ca?
Решение:
Ca + 2H2O = Ca(OH)2 + H2
Ca(OH)2 + H2CO3 = CaCO3 + 2H2O
CaCO3 ==t CaO + CO2
CaO + SO3 = CaSO4
CaSO4 + BaCl2 = CaCl2 + BaSO4
CaCl2 + Ba = BaCl2 + Ca
Задания по теме 5
161- 170. Подтвердите уравнениями реакций в молекулярном и ионном виде кислотные свойства оксидов. Назовите полученные вещества.
| № | ||||||||||
| оксид | CO2 | SO2 | SO3 | P2O5 | SiO2 | Cl2O5 | Cl2O7 | CrO3 | B2O3 | Mn2O7 |
171-180. Подтвердите уравнениями реакций в молекулярном и ионном виде основные свойства оксидов. Назовите полученные вещества.
| № | ||||||||||
| оксид | K2O | CaO | FeO | CuO | MnO | MgO | Na2O | ZnO | BaO | Al2O3 |
181-190. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения веществ:
| № | Схема превращений |
| Калий→гидроксид калия →карбонат калия→нитрат калия→сульфат калия | |
| Цинк→хлорид цинка→гидроксид цинка→оксид цинка→нитрат цинка | |
| Медь(II)→оксид меди→сульфат меди→гидроксид меди →оксид меди→хлорид меди | |
| Углерод→углекислый газ→карбонат натрия→карбонат кальция→углекислый газ | |
| Водород→вода→гидроксид натрия→карбонат натрия→нитрат натрия | |
| Сера→сероводород→сульфид натрия→сульфид железа(II)→сероводород | |
| Натрий→гидроксид натрия→сульфид натрия→хлорид натрия→сульфат натрия | |
| Магний→сульфат магния→гидроксид магния→оксид магния→хлорид магния | |
| Свинец→оксид свинца(II)→нитрат свинца→гидроксид свинца→оксид свинца→сульфат свинца | |
| Сера→сероводород→сульфид калия→хлорид калия→соляная кислота | |
| Кальций→гидроксид кальция→карбонат кальция→нитрат кальция→азотная кислота | |
| Алюминий→сульфат алюминия→гидроксид алюминия→оксид алюминия →нитрат алюминия | |
| Сера→оксид серы(IV)→сернистая кислота→сульфит натрия→сернистая кислота | |
| Кислород→оксид алюминия→сульфат алюминия→гидроксид алюминия →метаалюминат натрия | |
| Алюминий→хлорид алюминия→нитрат алюминия→гидроксид алюминия →сульфат алюминия | |
| Медь→хлорид меди(II)→медь→оксид меди(II)→нитрат меди | |
| Железо→хлорид железа(II)→гидроксид железа(II)→ сульфат железа(II)→железо | |
| Железо→хлорид железа(III)→нитрат железа(III)→сульфат железа(III)→железо | |
| Алюминий→нитрат алюминия→гидроксид алюминия→оксид алюминия →алюминат натрия→сульфат алюминия | |
| Цинк→тетрагидроксоцинкат натрия→нитрат цинка→гидроксид цинка→оксид цинка→цинкат калия |
Химические реакции.
Одним из типов взаимодействия атомов, молекул и ионов являются реакции, в которых одни реагенты отдают, а другие-приобретают электроны. В ходе таких реакций, называемых окислительно-восстановительными, атомы одного или нескольких элементов изменяют свою степень окисления.
|
|
|
Под степенью окисления понимают условный заряд, который возник бы на данном атоме, если считать, что все связи в частице (молекуле, сложном ионе) - ионные. При этом полагают, что электроны полностью смещены к более электроотрицательному атому, который сильнее их притягивает. Понятие о степени окисления является формальным и часто не совпадает ни с эффективными зарядами атомов в соединениях, ни с фактическим числом связей, которые образует атом. Однако, оно удобно при составлении уравнений окислительно-восстановительных процессов и полезно при описании окислительно-восстановительных свойств химических соединений.
Степени окисления атомов рассчитывают, исходя из следующих основных правил:Степень окисления обозначают надстрочным индексом над атомом, причем сначала указывают ее знак, а затем - величину. Она может быть как целым, так и дробным числом. Например, если в H2O и H2O2 для кислорода степень окисления равна (-2) и (-1), то в KO2и KO3- соответственно (-1/2) и (-1/3).
1) степень окисления атома в простых веществах равна нулю, например:
Na0; H20; Cl02; O20и т.д.;
2) степень окисления простого иона, например: Na+; Ca+2; Fe+3; Cl-; S-2 равна его заряду, т.е., соответственно, (+1); (+2); (+3); (-1); (-2);
3) в большинстве соединений степень окисления атома водорода равна (+1) (кроме гидридов Me - LiH; CaH и др., в которых она равна (-1));
4) степень окисления атома кислорода в большинстве соединений равна
(-2), кроме пероксидов (-1), фторида кислорода OF2(+2) и др.;
5) алгебраическая сумма значений степеней окисления всех атомов в моле-куле равна нулю, а в сложном ионе - заряду этого иона. Например, степень окисления азота в молекуле азотной кислоты - HNO3определяют следующим образом: степень окисления водорода равна (+1), кислорода (-2), азота (x). Составив алгебраическое уравнение: (+1) + x + (-2)·3 = 0, получают x = +5.
|
|
|
Возвращаясь к определению окислительно-восстановительных реакций, отметим, что окислением называют процесс отдачи электронов, а восстановлением - процесс их присоединения. Окислитель - вещество, содержащее элемент, у которого в ходе реакции степень окисления понижается. Восстановитель - вещество, содержащее элемент, у которого в ходе реакции степень окисления повышается. Следует подчеркнуть, что реакции окисления и восстановления невозможны одна без другой (сопряженные реакции). Таким образом, в результате окислительно-восстановительной реакции окислитель восстанавливается, а восстановитель - окисляется.
Типичные восстановители:
1) металлы, например: K, Mg, Al, Zn и некоторые неметаллы в свободном состоянии - C, H (в большинстве случаев) и др.;
2) простые ионы, соответствующие низшей степени окисления элемента: S2-; I; Cl-и др.;
3) сложные ионы и молекулы, содержащие атомы в низшей степени окис-
-3 -2 -
ления: N в ионе NH4, S в молекуле H2S, I в молекуле KI и др.
Типичные окислители:
1) атомы и молекулы некоторых неметаллов: F2; Cl и O2(в большинстве случаев) и др.;
2) простые ионы, соответствующие высшим степеням окисления элемента: Hg+2; Au+3; Pb и др.;
3) сложные ионы и молекулы, содержащие атомы в высшей степени окисления: Pb+4 в PbO2; N+5 в HNO3; S+6 в H SO4; Cr+6 в Cr2O72- или CrO42-; Mn+7 в MnO- и др.
Некоторые вещества обладают двойственной окислительно - восстановительной функцией, проявляя (в зависимости от условий) либо окислительные, либо восстановительные свойства. К ним относят молекулы некоторых веществ, простые и сложные ионы, в которых атомы находятся в промежуточной степени окисления: C+2 в молекуле CO, О- в молекуле H2O2, в S+4 ионе SO32-, в ионе N+3 в ионе NO2- и др.
В окислительно-восстановительной реакции происходит передача электронов от восстановителя к окислителю.
Пример 1 Напишите уравнение реакции окисления дисульфида железа (II) концентрированной азотной кислотой. Составьте: схемы электронного и электронно-ионного баланса.
Решение. НNО3 - сильный окислитель, поэтому сера будет окисляться до максимальной степени окисления S+6, а железо до Fe+3, при этом НNО3 может восстанавливаться до NO или NO2. Рассмотрим случай восстановления до NО2.
FеS2 + НNO3(конц) → Fе(NO3)3 + Н2SО4 + NО2.
Где будет находиться Н2О (в левой или правой части), пока неизвестно.
Уравняем данную реакцию методом электронного баланса. Процесс восстановления описывается схемой:
N+5 + e → N+4
В полуреакцию окисления вступают сразу два элемента - Fe и S. Железо в дисульфиде имеет степень окисления +2, а сера -1. Необходимо учесть, что на один атом Fе приходится два атома S:
Fe+2 – e → Fe+3
2S- - 14e → 2S+6.
Вместе железо и сера отдают 15 электронов.
Полный баланс имеет вид:
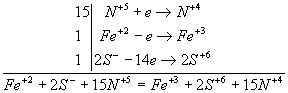
15 молекул НNО3 идут на окисление FеS2, и еще 3 молекулы НNО3 необходимы для образования Fе(NО3)3:
FеS2 + 18НNО3 → Fе(NО3)3 + 2Н2SО4 + 15NО2.
Чтобы уравнять водород и кислород, в правую часть надо добавить 7 молекул Н2О:
FeS2 + 18НNО3(конц) = Fе(NО3)3 + 2Н2SО4 + 15NО2 + 7Н2О.
Используем теперь метод электронно-ионного баланса. Рассмотрим полуреакцию окисления. Молекула FеS2 превращается в ион Fе3+ (Fе(NО3)3 полностью диссоциирует на ионы) и два иона SO42- (диссоциация H2SO4):
FeS2 → Fe3+ + 2SO24-.
Для того, чтобы уравнять кислород, в левую часть, добавим 8 молекул H2O, а в правую – 16 ионов Н+ (среда кислая!):
FeS2 + 8H2O → Fe3+ + 2SO42- + 16H+.
Заряд левой части равен 0, заряд правой +15, поэтому FеS2 должен отдать 15 электронов:
FеS2 + 8Н2О - 15е → Fе3+ + 2SО42- + 16Н+.
Рассмотрим теперь полуреакцию восстановления нитрат-иона:
NO-3 → NO2.
Необходимо отнять у NО3- один атом О. Для этого к левой части добавим 2 иона Н+ (кислая среда), а к правой — одну молекулу Н2О:
NО3- + 2Н+ → NО2 + Н2О.
Для уравнивания заряда к левой части (заряд +1) добавим один электрон:
NО3- + 2Н+ + е → NO2 + Н2О.
Полный электронно-ионный баланс имеет вид:

Сократив обе части на 16Н+ и 8Н2О, получим сокращенное ионное уравнение окислительно-восстановительной реакции:
FеS2 + 15NО3- + 14Н+ = Fе3+ + 2SО42- + 15NО2 + 7Н2О.
Добавив в обе части уравнения соответствующее количество ионов по три иона NО3- и Н+, находим молекулярное уравнение реакции:
FеS2 + 18НNО3(конц) = Fе(NО3)3 + 2Н2SО4 + 15NО2 + 7Н2О.
Химическая кинетика изучает скорости и механизмы химических процессов, а также зависимость их от различных факторов. Скорость химических реакций зависит от: 1) природы реагирующих веществ; 2) условий протекания реакции: концентрации реагирующих веществ; давления, если в реакции участвуют газообразные вещества; температуры; присутствия катализатора.
ПРИМЕР 2. Вычислите, во сколько раз возрастет скорость реакции при увеличении температуры на 40 °, если температурный коэффициент скорости этой реакции равен 3.
РЕШЕНИЕ. Зависимость скорости реакции от температуры выражается эмпирическим правилом Вант-Гоффа, согласно которому при увеличении температуры на каждые 10 ° скорость большинства гомогенных реакций увеличивается в 2-4 раза, или

где  - температурный коэффициент скорости реакции, часто принимает значения 2-4, показывает, во сколько раз увеличится скорость реакции при повышении температуры на 10 градусов;
- температурный коэффициент скорости реакции, часто принимает значения 2-4, показывает, во сколько раз увеличится скорость реакции при повышении температуры на 10 градусов;
vT1, vT2 - скорости химической реакции при температурах T1и T2. В данном примере:

Скорость реакции возрастёт в 81 раз
ПРИМЕР 3. Окисление оксида углерода (II) и графита протекает по уравнениям: а) 2СО(г)+ О= 2СО2(г);
б) 2С(т)+ О2(г)= 2СО(г).
Вычислите, как изменятся скорости этих реакций, если увеличить в три раза: 1) концентрацию кислорода; 2) объем реакционного пространства; 3) давление в системе.
Решение: Реакция а) протекает в гомогенной системе - все вещества находятся в одной фазе (все вещества газы), реакция б) протекает в гетерогенной системе - реагирующие вещества находятся в разных фазах (О2и СО - газы, С - твердое). Поэтому скорости реакций для этих систем согласно ЗДМ равны:
а) 2СО(г)+ О2(г) = 2СО; б) 2С(т) + О2(г) = 2СО(г);
а)  б)
б) 
После увеличения концентрации кислорода скорости реакций а) и б) будут равны:
a)  б)
б) 
Увеличение скорости реакции по отношению к первоначальной определяется соотношением:
А)  б)
б) 

Следовательно, после увеличения концентрации кислорода в 3 раза скорости реакций а) и б) возрастут в 3 раза.
2) Увеличение объема системы в 3 раза вызовет уменьшение концентрации каждого газообразного вещества в 3 раза. Поэтому скорости реакций уменьшатся соответственно в 27 раз (а) и в 3 раза (б):
А)  б)
б) 
3) Увеличение давления в системе в 3 раза вызовет уменьшение объема в 3 раза и увеличение концентрации газообразных веществ в 3 раза. Поэтому:
А)  б)
б) 
ПРИМЕР 4. Реакция разложения пентахлорида фосфора протекает по уравнению:
PCl5(г)= PCl3(г)+ Cl2(г);  H = +92,59 кДж.
H = +92,59 кДж.
В каком направлении сместится равновесие этой реакции при: а) увеличении концетрации PCl5; б) увеличении концентрации Cl2; в) повышении давления; г) понижении температуры; д) введении катализатора.
РЕШЕНИЕ. Смещением или сдвигом химического равновесия называется изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий протекания реакции. Направление смещения равновесия определяется по принципу Ле Шателье: если на систему, находящуюся в равновесии оказать какое-либо внешнее воздействие (изменить концентрацию, давление, температуру), то равновесие сместится в сторону той реакции (прямой или обратной), которая противодействует оказанному воздействию.
а) Увеличение концентрации реагентов (PCl5) увеличивает скорость прямой реакции по сравнению со скоростью обратной реакции, и равновесие смещается в сторону прямой реакции, т.е. вправо;
б) увеличение концентрации прдуктов (Cl2) реакции увеличивает скорость обратной реакции по сравнению со скоростью прямой реакции, и равновесие смещается влево;
в) увеличение давления смещает равновесие в сторону реакции, идущей с образованием меньшего количества газообразных веществ. В данном примере прямая реакция сопровождается образованием 2 моль газов (1 моль PCl3и 1 моль Cl2), а обратная – образованием 1 моль PCl5. Поэтому повышение давления приведет к смещению равновесия влево, т.е. в сторону обратной реакции;
г) так как прямая реакция протекает с поглощением теплоты), то понижение температуры смещает равновесие в сторону обратной (экзотермической реакции);
д) введение в систему катализатора не влияет на смещение равновесия, т.к. одинаково увеличивает скорость прямой и обратной реакций.
Задания по теме 6
201-220. По данным схемам составьте уравнения окислительно-восстановительных реакций, укажите окислитель и восстановитель:
| № | Схема реакции |
| KBr+KBrO3+H2SO4→Br2+K2SO4+H2O | |
| КСlO3+ Na2SO3→Na2SO4+MnO2+KOH | |
| PbS+HNO3→S+Pb(NO3)2+NO+H2O | |
| KMnO4+ Na2SO3+KOH→K2MnO4+ Na2SO4+ H2O | |
| P+ HNO3+ H2O→H3PO4+NO | |
| Cu2O+ HNO3→Cu(NO3)2+NO+ H2O | |
| КСlO3+ Na2SO3→S+ K2SO4+ MnSO4+ H2O | |
| HNO3+Ca→NH4NO3+Ca(NO3)2+H2O | |
| NaCrO2+PbO2+NaOH→Na2CrO4+Na2PbO2+ H2O | |
| K2Cr2O7+H2S+ H2SO4→S+Cr2(SO4)3+ K2SO4+ H2O | |
| КСlO3+ Na2SO3→КСl+ Na2SO4 | |
| KMnO4+HBr→Br2+ KBr+MnBr2+ H2O | |
| H3AsO3+ KMnO4+ H2SO4→H3AsO4+ MnSO4+ K2SO4+ H2O | |
| P+HClO3+ H2O→ H3PO4+HCl | |
| NaCrO2+ Br2+ NaOH→ Na2CrO4+NaBr+ H2O | |
| FeS+ HNO3→Fe(NO3)2+S+ NO+ H2O | |
| HNO3+Zn→N2O+ Zn(NO3)2+ H2O | |
| FeSO4+ КСlO3+ H2SO4→Fe2(SO4)3+КСl+ H2O | |
| K2Cr2O7+HCl→Cl2+CrCl3+ КСl+ H2O | |
| Au+ HNO3+ HCl→AuCl3+NO+ H2O |
221-230. Во сколько раз изменится скорость прямой реакции, если изменить температурный режим с Т1 до Т2? Температурный коэффициент приведен в таблице.
| № | ||||||||||
| Т1, К | ||||||||||
| Т2, К | ||||||||||
| γ |
231-240. Рассчитайте, во сколько раз изменится скорость реакции, если изменить условия протекания процесса.
| № | Процесс | Изменение условий |
| 2SO2(г)+O2↔2SO3(г) | Объем газовой смеси уменьшить в 3 раза | |
| CO(г)+H2O(г)↔CO2(г)+H2(г) | Объем СО увеличить в 2 раза | |
| N2(г)+3H2(г)↔2NH3(г) | Объем газовой смеси увеличить в 3 раза | |
| 2SO2(г)+O2↔2SO3(г) | Объем газовой смеси увеличить в 3 раза | |
| CO(г)+H2O(г)↔CO2(г)+H2(г) | Объем H2O(г) увеличить в 2 раза |
236-240. Как надо изменить а) температуру, б) давление, в) концентрацию, чтобы сместить химическое равновесие в сторону прямой реакции?
| № | Уравнение реакции | ?Н0, кДж/моль |
| 2H2(г)+O2(г)↔2H2O(г) | -484 | |
| 2NO(г)+O2(г)↔2NO2(г) | -112 | |
| Fe3O4(тв)+H2(г)↔3FeO(тв)+H2O(г) | ||
| FeO(тв)+H2(г)↔Fe(тв)+H2O(г) | -272 | |
| FeO(тв)+CO(г)↔Fe(тв)+CO2(г) | -11 |
Металлы и неметаллы.
Совокупность ОВР, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.
На катоде источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является «восстановителем». На аноде происходит отдача электронов анионами, поэтому анод является «окислителем». При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита или платины), как правило, конкурирующими являются два окислительных и восстановительных процесса:
- на аноде — окисление анионов и гидроксид-ионов,
- на катоде — восстановление катионов и ионов водорода.
При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими реакциями на электродах являются следующие:
- на аноде — окисление анионов и гидроксид ионов, анодное растворение металла — материала анода;
- на катоде - восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода. При выборе наиболее вероятного процесса на аноде и катоде исходят из положения, что протекает та реакция, которая требует наименьшей затраты энергии. При электролизе растворов солей с инертным электродом используют следующие правила.
1. На аноде могут образовываться следующие продукты:
а) при электролизе растворов, содержащих анионы F-, SО42-, NO3-, РO43-, ОН- выделяется кислород;
б) при окислении галогенид-ионов выделяются свободные галогены;
в) при окислении анионов органических кислот происходит процесс:
2RCOO- - 2е → R-R + 2СО2.
2. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl3+, на катоде выделяется водород; если ион расположен правее водорода, то выделяется металл.
3. При электролизе растворов солей, содержащих ионы, расположенные между Аl3+ и Н+ на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода.
Зависимость количества вещества, образовавшегося при электролизе, от времени и силы тока описывается обобщенным законом Фарадея:
m = (Э / F) • I • t = (М / (n • F)) • I • t,
где m — масса образовавшегося при электролизе вещества (г); Э — эквивалентная масса вещества (г/моль); М — молярная масса вещества (г/моль); n — количество отдаваемых или принимаем электронов; I — сила тока (А); t — продолжительность процесса (с); F — константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества (F= 96500 Кл/ моль = 26,8 А • ч / моль).
Пример 1 Электролиз расплава хлорида натрия:
NaCl = Na+ + Cl–;
катод (–) (Na+): Na+ + е = Na0,
анод (–) (Cl–): Cl– – е = Cl0, 2Cl0 = Cl2;
2NaCl = 2Na + Cl2.
Пример 2 Электролиз раствора хлорида натрия:
NaCl = Na+ + Cl–,
H2O = Н+ + ОН–;
катод (–) (Na+; Н+): H+ + е = H0, 2H0 = H2
(2H2O + 2 е = H2 + 2OH–),
анод (+) (Cl–; OН–): Cl– – е = Cl0, 2Cl0 = Cl2;
2NaCl + 2H2O = 2NaOH + Cl2 + H2.
Пример 3 Электролиз раствора нитрата меди(II):
Cu(NO3)2 = Cu2+ + NO3--
Н2O = H+ + OH–;
катод (–) (Cu2+; Н+): Cu2+ + 2 е = Cu0,
анод (+) (OН–): OH– – е = OH0,
4H0 = O2 + 2H2O;
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3.
Задания по теме 7
241-250. Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе а) расплава, б) раствора вещества:
| № | ||||||||||
| Вещество | NaOH | КСl | AgNO3 | Cu(NO3)2 | FeSO4 | K2S | KOH | Fe(NO3)2 | ZnSO4 | Zn(NO3)2 |
251-260. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе рёаствора в течение времени t(ч) при силе тока I(A).
| № | ||||||||||
| Вещество | КСl | FeSO4 | AgNO3 | Cu(NO3)2 | K2S | NaI | CuI2 | HgSO4 | NaCl | CaCl2 |
| t, (ч) | 2,5 | 1,5 | 0,5 | 2,5 | 1,5 | |||||
| I, (A) |
261-270. Как проявляет себя вещество в окислительно-восстановительных реакциях? Почему?
| № | ||||||||||
| Вещество | HClO | HCl | H2SO3 | H2SO4 | H2S | KNO2 | HClO4 | PH3 | MnO2 | PbO |
271-280. Составьте уравнение реакции между веществами, учитывая, что переход электронов максимальный.
| № | Вещества | № | Вещества |
| P+HNO3(конц) | H2S+ H2SO4(конц) | ||
| Р+H2SO4(конц) | PH3+HNO3(конц) | ||
| S+HNO3(конц) | PH3+ H2SO4(конц) | ||
| S+ H2SO4(конц) | HClO+HNO3(конц) | ||
| H2S+HNO3(конц) | HClO+ H2SO4(конц) |
Основная:
1. Ерохин Ю.М. «Химия»: Учебник для средних профессиональных учебных заведений.- М.: Издательский центр «Академия», 2004.
2. Рудзитис Г.Е., Фельдман Ф.Г. «Химия» 10 кл.-М.: Просвещение. 1995.
3. Рудзитис Г.Е., Фельдман Ф.Г. «Химия» 11 кл. –М.: Просвещение. 1995.
4. Ахметов М.С. «Лабораторные и семинарские занятия по общей и неорганической химии» М.: Высшая школа. 2002.
Дополнительная:
1. Петров М.М., Михилев Л.А., Кукушкин Ю.Н. «Неорганическая химия». М.: Химия. 1989.
2. Потапов В.М. «Органическая химия».- М.: Просвещение.1983.
3. Михилев Л.А., Пассет Н.Ф., Федотова М.И. «Задачи и упражнения по неорганической химии». М.: Химия. 1989.
4. Потапов В.М., Татаринчик С.Н., Аверина А.В. «Задачи и упражнения по органической химии» -М.: Химия. 1989.
5. Хомченко И.Г. «Общая химия». –М.: Новая волна. –ОНИКС 1999.
6. Хомченко Г.П. «Сборник задач по химии для поступающих в Вуз». –М.: Новая волна. 1999.
 2015-10-22
2015-10-22 38390
38390