Оксид олова(II) — неорганическое бинарное химическое соединение олова и кислорода, химическая формула SnO, черно-синие кристаллы (по другим данным коричневато-чёрные).
Оксид олова является полупроводником, тип проводимости которого зависит от примесей и способа получения.
Оксид олова получают осторожным разложением в инертной атмосфере гидроокиси олова:
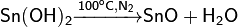
Из диоксида олова:
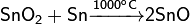
Оксид олова(II) устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей.
Гидроксид олова(II) — неорганическое соединение, гидроокись олова формулой Sn(OH)2, гелевидный белый осадок, плохо растворимый в воде, проявляет амфотерные свойства.
Получают осаждением щелочами из раствора солей двухвалентного олова:
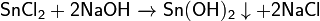
· При нагревании легко теряет воду:
· Проявляет амфотерные свойства, растворяется в кислотах и щелочах.
Хлорид олова (SnCl2) — белый порошок. Плавится и кипит без разложения. Хорошо растворяется в малом количестве воды, при разбавлении раствора выпадает в осадок. Соль SnCl2 ∙ 2H2O имеет строение [Sn(H2O)Cl2] ∙ 2H2O («оловянная соль»). Реагирует со щёлочами, гидратом аммиака. Сильный восстановитель, слабый окислитель.
Получение
· Кристаллизация водного раствора хлористого олова;
· Растворение олова в соляной кислоте;
· Нагревание олова в токе хлористого водорода.
Оксид свинца( PbO ) — бинарное неорганическое соединение металла свинца и кислорода, красные или жёлтые кристаллы, плохо растворимые в воде.
Получение:
· Пропуская воздух через расплавленный свинец.
· Нагревание гидроксида свинца, карбоната свинца.
· Разложение нитрата свинца, диоксида свинца.
· Окисление сульфида свинца.
Оксид свинца диамагнитен, обладает полупроводниковыми свойствами, тип проводимости зависит от состава.
· Проявляет амфотерные свойства, реагирует с кислотами, и щелочами.
· Во влажном состоянии поглощает углекислоту с образованием основной соли.
· Окисляется кислородом
· Бромом в водной суспензии окисляется до диоксида свинца
Гидроксид свинца — неорганическое соединение, гидроокись металла свинца с формулой Pb(OH)2, белое аморфное вещество или прозрачные кристаллы, плохо растворимые в воде.
Получение
· Осаждение щелочью растворимой соли двухвалентного свинца.
· Окисление свинца в присутствии воды при нагревании.
· При нагревании разлагается.
· Проявляет амфотерные свойства, реагирует с кислотами и щелочами.
· Поглощает углекислоту с образованием основной соли.
· В щелочной среде окисляется перекисью водорода.
Соли свинца(II):
Сульфа́т свинца́( PbSO4 ). В природе распространён как минерал англезит. Применяется как компонент пигментов. Образуется в свинцово-кислотных аккумуляторных батареях при разряде. Температура плавления: 1170 °C (с разложением). Практически не растворим в воде.
Нитрат свинца (Pb(NO3)2) — неорганическое химическое соединение. В обычном состоянии — бесцветные кристаллы или белый порошок. Хорошо растворим в воде.
Его получают растворением в разбавленной азотной кислоте свинца, его оксида или гидроксида, кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца.
Ацетат свинца (Pb(CH3COO)2) — химическое соединение, свинцовая соль уксусной кислоты. В нормальных условиях представляет собой прозрачные кристаллы. Тригидрат имеет сладкий вкус, однако, как и другие соединения свинца, он сильно токсичен.
Ацетат свинца(II) получают взаимодействием уксусной кислоты с оксидом или карбонатом свинца(II).
Образует бесцветные прозрачные кристаллы. Безводный ацетат свинца плавится при 280 °С с частичной возгонкой и разложением на Pb, CO2, H2O и ацетон.
Хромат свинца(II) — неорганическое соединение, соль металла свинца и хромовой кислоты с формулой PbCrO4, жёлтые кристаллы, не растворимые в воде.
Получение
· В природе встречается минерал крокоит — хромат свинца с примесями серебра и цинка.
· Действие хромата калия на нитрат свинца:
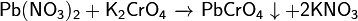
· Растворяется в концентрированных кислотах:
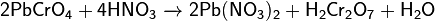
· и щелочах:
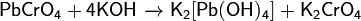
Солеобразные оксиды – это двойные оксиды, в состав которых входят атомы одного металла в разных степенях окисления.
Металлы, проявляющие в соединениях несколько степеней окисления, образуют двойные, или солеобразные оксиды. Например, Pb3O4,
От гидрата оксида свинца (IV), как от кислоты, и Pb(OH2), как основания, могут быть получены два двойных оксида Pb2O3, Pb3O4 (сурик), которые можно рассматривать как соли. Первый является свинцовой солью метасвинцовой кислоты (H2PbO3), а второй – ортосвинцовой кислоты (H4PbO4).
Солеобразные оксиды не проявляют ни кислотных, ни основных свойств. Ведь данные свойства сводятся к образованию солей, а солеобразные оксиды – это уже соли.
 2018-01-21
2018-01-21 7071
7071








