Азот — двухатомный газ без цвета, вкуса и запаха. Один из самых распространённых элементов на Земле. Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09 % объёма), разделением которого получают промышленный азот, (более ¾ идёт на синтез аммиака). Применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент
Получение азота из атмосферы - это один из самых экономичных способов, в ходе которого очищенный воздух последовательно сжижают путем охлаждения и расширения. Полученный жидкий воздух перегоняют через фракции, медленно поднимая при этом температуру. При этом процессе сначала выделяются благородные газы, а затем азот. Остается только жидкий кислород.
Химические свойства азота - инертность, т.е. минимальная химическая активность. Атом азота может образовывать связь с другим атомом азота, что достаточно необычно для химических элементов (исключение составляют лишь кремний и углерод).
Причина инертности молекулярного азота – крайне прочная ковалентная неполярная связь. Два атома в молекуле удерживаются одной σ - связью и двумя π- связями. Т.е. связи в молекуле азота неравноценны. На разрушение молекулы азота на атомы затрачивается довольно большое количество энергии:
N2 = 2N ∆H0 = 946 кДж/моль
Аммиа́к - химическое соединение с формулой NH3, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта и мочи).
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине.
В жидком аммиаке молекулы связаны между собой водородными связями.
Способ получения аммиака основан на прямом взаимодействии водорода и азота:  + 91,84 кДж
+ 91,84 кДж
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
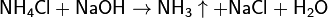
Все соли аммония хорошо растворимы в воде и полностью диссоциируют в водном растворе. Соли аммония проявляют общие свойства солей. При действии на них щёлочи выделяется газообразный аммиак. Все соли аммония при нагревании разлагаются.
1. Сильные электролиты (диссоциируют в водных растворах).
2. Разложение при нагревании
3. С кислотами (реакция обмена).
4. C солями (реакция обмена).
5. Соли аммония подвергаются гидролизу — среда кислая.
6. При нагревании со щелочами выделяют аммиак.
Нитриды — соединения азота с менее электроотрицательными элементами, напри-мер, с металлами (AlN;TiNx;Na3N;Ca3N2;Zn3N2) и с рядом неметаллов (NH3, BN, Si3N4).
Нитриды ионного типа получаются при взаимодействии металлов с азотом при температурах 700—1200 °C. Другие нитриды можно получить взаимодействием металла с азотом или аммиаком или восстановлением оксидов, хлоридов металла углеродом в присутствии азота или аммиака при высоких температурах.
Нитриды ионного типа легко разлагаются водой и кислотами, проявляя основные свойства.
Нагревание нитридов элементов V, VI и VIII групп приводит к их разложению с выделением азота, низших нитридов и твердых растворов азота в металлах.
Окисление нитридов кислородом приводит к образованию оксидов металлов и азота.
 2018-01-21
2018-01-21 5983
5983
