Гидразин (NH2NH2) – это сильно гигроскопическая жидкость, обладающая заметной способностью поглощать из воздуха углекислоту и кислород. Гидразин хорошо растворяется в воде, спиртах, аммиаке, аминах. Он нерастворим в углеводородах и их галоидопроизводных. Водные растворы обладают основными свойствами. Гидразин является сильным восстановителем. Благодаря этому он термодинамически неустойчив и легко разлагается под влиянием катализаторов, при нагревании до высоких температур, при действии излучений. На воздухе горит синим пламенем. При этом выделяется значительное количество энергии.
Гидразин получают по методу Рашига, первая стадия которого состоит в действии хлора на аммиак, в результате чего образуется непрочный хлорамин. Хлорамин далее взаимодействует с избытком аммиака в щелочной среде.
Химические свойства гидразина определяются, во-первых, тем, что его молекула состоит из двух аминогрупп, обладающих слабо основными свойствами.
Особенность гидразина - его сильнейшие восстановительные свойства, что вызвано как присутствием в его молекуле непрочной связи азот-азот, так и аномальной степенью окисления атомов азота (-2).
Соли гидразина — хлорид гидразиния N2H5Cl, сульфат гидразония N2H6SO4 и т. д. Большинство таких солей растворимо в воде. Они бесцветны, почти все хорошо растворимы в воде.
Гидразин применяют в органическом синтезе, в производстве пластмасс, резины, инсектицидов, взрывчатых веществ, в качестве компонента ракетного топлива.
Гидразина сульфат применяется в случае таких заболеваний, как онкология.
Гидразин-гидрат — бесцветная жидкость, легко поглощает из воздуха воду, углекислоту и кислород, хорошо растворим в воде и спирте, токсичен, а при концентрациях, превышающих 40% горюч.
Гидроксиламин
В молекуле гидроксиламина ( NH2OH) атом азота имеет непоселенную пару электронов. Гидроксиламин хорошо растворяется в воде, а с кислотами дает соли, например хлорид гидроксиламмония.
В водном растворе диссоциирует по основному типу, являясь слабым основанием.
Может также диссоциировать и по кислотному типу.
Гидроксиламин реагирует с кислотами, образуя соли гидроксиламиния.
На воздухе соединение является нестабильным.
На воздухе легко окисляется кислородом воздуха.
Гидроксиламин проявляет свойства восстановителя, при действии на него окислителей выделяются N2 или N2O.
Получают восстановлением NO водородом в присутствии платинового катализатора или гидрированием азотной кислоты, а также действием на азотную кислоту атомарным водородом:
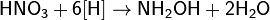
Важнейшей солью гидроксиламина является солянокислый NH2OH·HCl. Он применяется как восстановитель в неорганическом анализе; для количественного определения формальдегида, фурфурола, камфоры, глюкозы; в фотографии и медицине.
Применяется в органическом синтезе. Гидроксиламин, взаимодействуя с альдегидами и кетонами, образует оксимы: R—CH=NOH и R2—C=NOH.
 2018-01-21
2018-01-21 4921
4921








