состояние химического равновесия сохраняется до тех пор, пока остаются неизменными условия реакции: концентрация, температура и давление.
Принцип Ле-Шателье: если на систему, находящуюся в равновесии оказано какое-либо внешнее воздействии, то равновесии сместится в сторону той реакции, которое это действие будет ослаблять.
Константа равновесия – это мера полноты протекания реакции, чем больше величина константы равновесия, тем выше степень превращение исходных веществ в продукты реакции.
Кр=Спр\Сисх

|
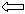 ΔG<0 Кр >1 Спр > Сисх
ΔG<0 Кр >1 Спр > Сисх
ΔG>0 Кр<1 Спр <Сисх
Задачи химической термодинамики:
1) Изучение энергетических химических и физико-химических процессов
2) Абсоретический анализ. Возможность протекания химических реакций и осуществление химических процессов при заданных условиях.
Тепловой эффект химических реакций (G) – количество теплоты выделяемой или поглощенной при изотермическом проведении реакции.
Q>0 (экзотермическая реакция) Q<0 (эндотермическая реакция)
Законы термохимии
| Q(пр) = -Q(обр) |
1) Закон Лавуазье-Лапласа: тепловой эффект прямой реакции всегда равен всегда равен тепловому эффекту обратной реакции с противоположным знаком.
2) Закон Гесса: тепловой эффект не зависит от пути его протекания и числа его стадий, а зависит от начального и конечного состояния.
Первый закон термодинамики
| ΔU = Q – A. |
| Q = ΔU + A. |
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Энтальпия - это тепловой эффект реакции, измеренный (или вычисленный) для случая, когда реакция происходит в открытом сосуде (т.е. при неизменном давлении). Обозначается как ΔH.
Стандартная энтальпия образования простых веществ и химических соединений- энтальпия при стандартных условиях Т-289К P=1,013*103 Па µ=1 моль
|
|

 2018-01-21
2018-01-21 801
801







