В никель-железных и никель-кадмиевых аккумуляторах активная масса положительного электрода в заряженном состоянии состоит из гидрата окиси никеля NiOOH, к которому добавляют графит и окись бария. Графит увеличивает электропроводность активной массы, а окись бария — срок службы электрода. Активная масса отрицательного электрода никель-железного аккумулятора состоит из порошкового железа Fe и его окислов с добавкой сернокислого никеля и сернистого железа, а никель-кадмиевого аккумулятора — из смеси порошков кадмия Cd и железа Fe. Электролитом служит 20 %-ный раствор едкого калия КОН с примесью моногидрата лития (20—30 г/л). Эта примесь увеличивает срок службы аккумулятора.
Оба электрода в этих аккумуляторах изготовляют в виде стальных никелированных рамок
Разряд и заряд. При разряде щелочного аккумулятора гидрат окиси никеля NiOOH на положительном электроде, взаимодействуя с ионами электролита, переходит в гидрат закиси никеля Ni(OH)2, а железо или кадмий отрицательного электрода превращается соответственно в гидрат окиси железа Fe(ОН)2 или гидрат окиси кадмия CdOН2. Между электродами возникает разность потенциалов около 1,45 В, обеспечивающая протекание тока по внешней цепи и внутри аккумуляторов.
При заряде аккумулятора под действием электрической энергии, подводимой от внешнего источника тока, происходит окисление активной массы положительных пластин, сопровождаемое переходом гидрата закиси никеля Ni (ОН)2 в гидрат окиси никеля NiOOH. В то же время активная масса отрицательных пластин восстанавливается с образованием железа Fe или кадмия Cd. Электрохимические реакции при разряде и заряде никель-железного аккумулятора могут быть выражены уравнением
2Ni(OOH) + 2KOH + Fe? 2Ni(OH)2 + 2KOH + Fe(OH)2
Вопрос 31.
Коррозия – это процесс разрушения металлов в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты коррозии, состав которых зависит от условий коррозии. Коррозия – самопроизвольный процесс и поэтому протекает с уменьшением энергии Гиббса.
Различают химическую, биохимическую и электрохимическую коррозию металлов. Химическая коррозия металлов представляет собой их самопроизвольное разрушение, в основе которого лежат законы обычных гетерогенных химических реакций. Разрушение металлов под действием агрессивных газов при высоких температурах, исключающих конденсацию влаги на поверхности металла, а также, по-видимому, их растворение в условиях контакта с органическими средами, не проводящими тока, относятся к процессам химической коррозии.
Биохимическая коррозия, или биокоррозия, вызывается жизнедеятельностью различных микроорганизмов или использующих металл как питательную среду, или выделяющих продукты, действующие разрушающе на металл. Биокоррозия обычно накладывается на другие виды коррозии. Для ее развития наиболее благоприятны почвы определенных составов, застойные воды и некоторые органические продукты.
Электрохимическая коррозия подчиняется законам электрохимической кинетики. Скорость ее можно определить на основе законов Фарадея. Электрохимическая коррозия встречается чаще всего и наиболее опасна для металлов. Она может протекать в газовой атмосфере, когда на поверхности металла возможна конденсация влаги (атмосферная коррозия), в почвах (почвенная коррозия) и в любых растворах электролитов.
Вопрос 32.
Методы защиты металлов от коррозии:
1) применение защитных покрытий; (металлические, неметаллические, и химические)
Способствует изоляции металла от агрессивной среды. Металлические покрытия используют для покрытия корродирующего металла слоем другого металла, практически не разрушающегося в тех же условиях. Анодное покрытие – если оно изготовлено из металла, с меньшим электродным потенциалом, чем защищаемый металл. Катодное покрытие – если оно изготовлено из металла, с большим электродным потенциалом.
Неметаллические покрытия – эмалью, пластмассой, лаком…
Для создания химических покрытий поверхность защищаемого металла подвергают определенной химической обработке с целью получения на нем пленки соответствующего соединения металла, стойкого к коррозии:
· оксидирование: получение тонких прочных пленок соответствующих оксидов металлов;
· фосфатирование: получение тонких прочных пленок соответствующих фосфатов;
· азотирование: осуществляют насыщением поверхности металла азотом путем длительного нагревания в атмосфере аммиака при t=500-6000C;
· цементация: создание на поверхности металла его соединения с углеродом.
· Легирование: вводят в состав сплава компоненты вызывающие пассивацию металла(введение в сталь 12% хрома)
При реализации электрохимической защиты (присоединяют к катоду внешнего источника постоянного тока)(в качестве анода используют лом, который и разрушается).
Изменение состава коррозионной среды можно осуществлять в 2-х вариантах: введение ингибиторов коррозии, удаление вредных веществ из окружающей среды.
Вопрос 33.
Электролиз - совокупность процессов, происходящих на электродах, погруженных в раствор или расплав электролита, под действием электрического тока, подаваемого от внешнего источника.
Процессы на катоде.
1) На катоде могут восстанавливаться как катионы соли, так и молекулы воды. Все катионы металлов можно разделить на 3 группы: 1)металлы, стоящие в ряду напряжений до Al включительно никогда не восстанавливаются из растворов, восстанавливается только вода: 2H2O + 2e- = H2 + 2OH-
2) Металлы, стоящие в ряду от Mn до Н2; восстанавливаются на катоде вместе с молекулами воды: 2H2O + 2e- = H2 + 2OH- Men+ + ne- = Me;
3) Металлы, стоящие в ряду после Н2 сами восстанавливаются на катоде: Men+ + ne- = Me;
Процессы на аноде.
1) Если кислотный остаток бескислородный, то на аноде окисляется сам кислотный остаток: 2Cl- + 2e- = Cl2;
2) Исключение HF. Если кислотный остаток кислородосодержащий, то на аноде окисляется вода: 2H2O – 4e- = O2 + 4H+
3) Электрод растворимый активный, то на аноде окисляется сам металл, из которого изготовлен электрод: Cu - 2e- = Cu2+
4) Гидроксид-ионы в щелочной среде: 2OH- - 2e- = 0,5O2 + H2O.
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
m=kIt
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
It=Q
Постоянная Фарадея = 96500Кл.
m=MэIt/F.
Вопрос 34.
Очистка или рафинирование металлов. Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластинка из чистого металла, а электролитом — раствор соли данного металла, например, при рафинировании меди — раствор медного купороса. В загрязненных металлах могут содержаться ценные примеси. Так, в меди часто содержится никель и серебро. Для того чтобы на катоде выделялся только чистый металл, необходимо учитывать, что выделение каждого вещества начинается лишь при некоторой определенной разности потенциалов между электродами, называемой "потенциалом разложения". При надлежащем ее выборе из раствора медного купороса на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
Электрометаллургия. Некоторые металлы, например, алюминий, получают методом электролиза из расплавленной руды. Электролитической ванной и одновременно катодом служит железный ящик с угольным полом, а анодом — угольные стержни. Температура руды (около 900 °С) поддерживается протекающим в ней током. Расплавленный алюминий опускается на дно ящика, откуда его через особое отверстие выпускают в формы для отливки.
Гальваностегия — электролитический способ покрытия металлических изделий слоем благородного или другого металла (золота, платины), не поддающегося окислению. Например, при никелировании предмета он сам служит катодом, кусок никеля — анодом. Пропуская через электролитическую ванну в течение некоторого времени электрический ток, покрывают предмет слоем никеля нужной толщины.
Гальванопластика, или электролитическое осаждение металла на поверхности предмета для воспроизведения его формы, была изобретена в 1837 г. русским ученым Б. С. Якоби, предложившим использовать электролиз для получения металлических отпечатков рельефных предметов (медалей, монет и др.). С предмета снимают слепок из воска или вырезают выпуклое изображение на деревянной доске и делают его проводящим, покрывая слоем графита. Затем опускают слепок или доску в качестве катода в электролит. Анодом служит кусок металла, используемого для осаждения. Этим способом изготовляют, например, типографские клише.
Электролитическим путем получают тяжелую воду (D2O), в которой атомы водорода заменены атомами его изотопа — дейтерия (D) с атомной массой 2.
Вопрос 35.
Вода – бесцветная летучая жидкость, в толстом слое – голубая, без запаха, плотность – 1г/см3(при 40С), tпл. = 00С, tкип. = 1000С. вода является хорошим растворителем.
Молекула воды имеет угловое строение. Входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а на вершине – ядро атома кислорода. Кислород в молекуле воды находится в состоянии sp3-гибридизации. Поэтому валентный угол НОН (104,3) близок к тетраэдрическому(109,5)
Молекулярная масса парообразной воды равна 18.
Вода, содержащая значительное количество солей кальция и магния называется жесткой.
Вода обладает высокой теплоемкостью(4,18 Дж/г*К), поэтому является регулятором температуры на земном шаре.
Химические свойства:
При пропускании через подкисленный раствор электрического тока вода разлагается на простые вещества: кислород и водород: 2Н2О? 2Н2 + О2.
Вода вступает во взаимодействие со щелочными и щелочноземельными металлами при обычных условиях, при этом в молекуле воды один атом водорода замещается на атом металла и образуются щёлочь и водород. Реакция протекает с выделением большого количества теплоты. 2Na + 2H2O = 2NaOH + H2
При взаимодействии основных оксидов с водой образуется щёлочь. Например, при взаимодействии оксида кальция (негашёной извести) с водой образуется гидроксид кальция (гашёная известь): CaO + H2O = Ca(OH)2.
Кислотные оксиды растворяются в воде с образованием кислот, например, оксид серы(IV) при растворении в воде образует сернистую кислоту: SO2 + H2O = H2SO3.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
Водоро́дный показа́тель, pH — мера активности ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный десятичный логарифм активности водородных ионов, выраженной в молях на литр.
рОН – гидроксильный показатель.
Буферные растворы — растворы с определенной концентрацией водородных ионов, содержащие сопряженную кислотно-основную пару, обеспечивающую устойчивость величины их водородного показателя при незначительных изменениях концентрации либо при добавлении небольшого количества кислоты или щелочи.
Кислотно-основная пара Б. р. представляет собой слабую кислоту и ее соль, образованную сильным основанием (например, уксусная кислота СН3СООН и ацетат натрия CH3COONa) или слабое основание и его соль, образованную сильной кислотой (например, гидроокись аммония NH4OH и хлористый аммоний NH4CI). При разведении раствора или добавлении к нему некоторого количества кислоты или щелочи кислотно-основная пара способна соответственно быть донором либо акцептором водородных ионов
Вопрос 36.
Нужно обязательно знать разницу между чистыми веществами и смесями. Также есть два понятия чистоты веществ – бытовое и лабораторное. В первом случае чистота относительна, во втором имеется ввиду вещетво без примесей иных веществ. В природе абсолютно чистых веществ нет, их можно получить лишь искусственно.
Смесь — физико-химическая система, в состав которой входят два или несколько химических соединений (компонент)
Смеси веществ состоят из двух и более компонентов. Смеси делят, в свою очередь, на неоднородные и однородные. Неоднородные смеси отличаются тем, что можно увидеть отдельные компоненты. К таким смесям относятся: чернила, паста, камни, бетон, молоко и многие другие.
Однородные смеси характеризуются тем, что их компоненты визуально неотделимы друг от друга. Это минеральные воды, морская вода, воздух, всевозможные растворы и т.д.
Смеси часто разделяют для получения отдельных компонентов. Методы разделения многочисленны, их для удобства разделяют по видам разделяемых смесей.
Неоднородные смеси разделяют отстаиванием и фильтрованием. Это самые легкодоступные методы. Отстаивание основано на разных плотностях компонентов и довольно длительно. Фильтрование основано на разных размерах компонентов и применяет фильтры для их разделения.
Однородные смеси чаще разделяют выпариванием – когда важен компонент, обладающий более высокой температурой кипения, и дистилляцией, когда нужно собрать испаряющийся сразу компонент. Дистилляцией часто пользуются для получения очищенной воды в лабораториях.
Механические смеси (эвтектики, эвтектоиды) — микроскопически малые, тесно перемешанные и связанные между собой компоненты сплава, состоящие из чистых металлов, твердых растворов и химических соединений. В сплавах, отличных по составу от эвтектических, при затвердевании в первую очередь выпадает компонент, избыточный по отношению к эвтектическому.
Коллоидные растворы – микрогетерогенные, метастабильные системы с жидкой средой, содержащей очень мелкие частицы, участвующие в интенсивном броуновском движении. Поэтому они равномерно распределены по объему и очень медленно осаждаются. Золи кажутся однородными и прозрачными.
Как видно, коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями. Коллоидные частицы обычно состоят из большого числа молекул или ионов.(молоко, клей)
Истинный раствор – однофазная система, переменного состава, содержащая атомы, ионы или молекулы и их различные ассоциаты.
Растворитель – вещество, находящееся в большем количестве.
Все растворы можно разделить на жидкие, твердые(сплавы) и газообразные (воздух).
Растворимость – предельно возможная концентрация растворенного вещества, отвечающая этому фазовому равновесию.
Насыщенный раствор – раствор, находящийся в фазовом равновесии с растворенным веществом.
Ненасыщенный раствор – раствор, в котором при данных температуре и давлении возможно дальнейшее растворение уже содержащегося в нем вещества.
Пересыщенный раствор – раствор, в котором содержание растворенного вещества больше, чем в насыщенном растворе этого же вещества при тех же условиях.
Вопрос 37.
Процесс растворения твердого вещества обусловлен разрывом межмолекулярных и внутримолекулярных его связей, что требует затраты энергии.
Суммарное изменение энергии в процессе растворения твердого вещества или изменение энтальпии растворения можно представить в виде алгебраической суммы изменений энтальпий для трех стадий: ∆Нр-ния = (∆Нк+∆Нр)+ ∆Нс – уравнение Фаянса.
Если | ∆Нк+∆Нр| >| ∆Hc |, то растворение будет происходить с поглощением энергии(∆Н>0) и, наоборот.
При растворении твердых веществ ∆S увеличивается, что вызвано переходом частиц растворяемого вещества из упорядоченного состояния в хаотическое. Чем больше ∆S тем больше растворимость.
Массовая доля – отношение массы растворенного вещества, к массе раствора. ω=mр.в./mр-ра
Молярная концентрация -отношение количества растворенного вещества к объему раствора. Так, означает раствор, в каждом литре которого содержится 2 моля серной кислоты, т. е. моль/л.
См=nр.в./Vр-ра [моль/л]
Молярная концентрация эквивалента -отношение количества растворенного вещества эквивалента к объему раствора.
Сэ=nэ/ Vр-ра
Моляльная концентрация – отношение количества растворенного вещества к массе растворителя [моль/кг]
Сm=nр.в./mр-ля
Мольная доля - отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, составляющих раствор.
Х=nр.в./nр.в.+nр-ля
Вопрос 38.
Диффузия – свойство вещества равномерно распределяться по всему предоставленному ему объему.
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
Закон Вант-Гоффа: осмотическое давление разбавленных идеальных растворов численно равно тому давлению, которое оказывало бы растворенное вещество, если бы при данной температуре оно в виде газа занимало объем раствора. Росм.=СМRT
Также свойством для всех жидких растворов является понижение давления насыщенного пара компонентов по сравнению с соответствующими характеристиками чистых веществ.
Закон Рауля: при постоянной температуре давление насыщенного пара компонента идеального раствора пропорционально его мольной доле (N) в растворе: Р=Р0Nр-ля, где Р – давление насыщенного пара растворителя над раствором. Р0 – давление насыщенного пара растворителя над чистым растворителем. Nр-ля=nр-ля/(nр-ля+nр.в.)
Эбулиоскопический метод заключается в определении того давления, при котором в процессе повышения вакуума исследуемый раствор закипает при заданной температуре
Эбулиоскопическим методом определяют также молекулярные массы растворенных веществ. Однако им можно пользоваться только в том случае, если растворенное вещество нелетучее и растворитель не распадается при температуре кипения раствора. [3]
Достоинство эбулиоскопического метода определения молекулярной массы заключается в том, что при этом удается определить число всех молекул высокомолекулярного вещества, включая наиболее низкомолекулярные фракции.
При эбулиоскопическом методе измерение повышения точки кипения дифференциально; применялся один кипятильник, содержавший только чистый растворитель, и второй кипятильник, содержавший; раствор известного состава. При такого рода измерениях надо иметь уверенность в том, что обе точки кипения определяются при одном и том же дпвлении и что состав жидкого раствора во втором кипятильнике вычислен правильно. Здесь имеется в виду, что если состав определяется на основании первоначально приготовленного жидкого раствора, загруженного в кипятильник, должна вводиться соответствующая поправка на некоторое-уменьшение количества растворителя в жидкси фазе, которое в результате испарения переходит в газовую фазу в пространстве над жидкостью до холодильника и которое в виде жидкости смачивает стенки парового пространства. [8]
Криоскопический метод определения молекулярной массы какого-либо вещества основан на понижении температуры замерзания раствора этого вещества по сравнению с температурой замерзания чистого растворителя. В качестве растворителя легких фракций нефти обычно употребляют бензол, а более высокомолекулярных фракций - нафталин, камфару.
Приборы Бекмана для определения молекулярного веса растворенных веществ.| Понижение температуры плавления растворов.
Криоскопический метод определения молекулярного веса широко применяется в обычной химической практике, особенно в органической химии.
Криоскопический метод определения молекулярной массы, однако, не свободен от погрешностей, и в ряде случаев пользоваться им не рекомендуется. Во-первых, в основу этого метода положен закон Рауля, применимый лишь к разбавленным растворам; поэтому с повышением концентрации исследуемого вещества в растворителе наблюдается отклонение от действия этого закона. Кроме того, в применяемых растворителях многие вещества, например ароматические УВ, соединения кислого характера, проявляют склонность к ассоциации, которая тем сильнее, чем выше концентрация раствора. На практике, однако, работа с очень разбавленными растворами влечет за собой другую ошибку, так как при небольших навесках получаемая депрессия слишком мала и возможны ошибки при отсчете.
Криоскопический метод определения выхода продукта реакции [2] состоит из ряда последовательных операций.
Криоскопический метод определения молекулярных весов нефтяных смол и асфальтенов, при правильном выборе растворителя, температуры и концентрационных пределов растворов, позволяет получать устойчивые и хорошо воспроизводимые результаты.
Описан криоскопический метод определения количества примеси, температур кристаллизации и криоскопических констант органических веществ. В первом варианте метода величина образца составляет 1 г, точность регистрации температуры 0 05; исследованные этим методом вещества содержат 1 - 3 мол. Во втором варианте величина образца также составляет 1 г, но точность регистрации температуры 0 01; этим методом исследовались более чистые вещества, содержащие меньше 1 мол. В третьем варианте (микроварианте) вес образца - сотые или десятые доли грамма, точность регистрации температуры 0 05 и точность определения количества примеси 0 05 мол.
Разработан видоизмененный криоскопический метод определения содержания индивидуальных компонентов в сложных смесях.
Основой криоскопического метода определения молекулярной массы полимера является закон Рауля.
Вопрос 39.
Электролиты – вещества, обладающие ионной проводимостью тока.
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов — катионов и анионов.
Основные положения теории электролитической диссоциации Аррениуса:
1. В растворах электролитов происходит самопроизвольный распад – диссоциацмя молекул на ионы, в результате чего раствор становится электропроводящим.
2. осмотическое давление, tп и tк растворов электролитов зависят не только от аналитической концентрации электролита, но и от степени его диссоциации.
3. для одного и того же растворенного вещества степень диссоциации увеличивается по мере разбавления растворов.
К электролитам относятся твердые вещества с ионной кристаллической решеткой (большинство солей и оснований) или вещества, состоящие из молекул с полярной связью – HCl, H2SO4, NH3.
Коэффициент изотонический i (коэффициент Вант-Гоффа) – число, показывающее во сколько раз общее количество частиц в растворе больше, чем количество молекул электролита (N)
Степень диссоциации электролитов α- отношение числа частиц молекул, распавшихся на ионы, к общему числу молекул растворенного вещества. Дало возможность разделить электролиты на сильные и слабые.
Сильные (α>30%)
Слабые (α=3-5%).
Вопрос 40.
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Слабыми электролитами являются:
почти все органические кислоты и вода;
некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H3PO4,H2CO3, H2SiO3, H2SO3 и др.;
некоторые малорастворимые гидроксиды металлов: Fe(OH)3, Zn(OH)2 и др.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Кd
Константы электролитической диссоциации слабых электролитов постоянны и практически независимы от концентрации водного раствора.
Константы электролитической диссоциации слабых электролитов при данной температуре и давлении являются постоянными величинами. Однако это не следует понимать в том смысле, что и степень электролитической диссоциации слабых электролитов представляет собой тоже постоянные величины. Степень электролитической диссоциации электролита меняется с изменением концентрации раствора.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролитаот концентрации раствора: Кдисс.=α2С
Вопрос 41.
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Для сильных электролитов в большей степени подходит термин кажущаяся степень диссоциации. Его находят, как отношение кажущегося количества диссоциированных частиц к реальному или из формулы определения изотонического коэффициента (называется фактором Вант-Гоффа и показывает истинное поведение вещества в растворе): α = (i – 1)/(n – 1). Здесь i — изотонический коэффициент, а n — количество образовавшихся ионов. Для растворов, молекулы которых полностью распались на ионы, α ≈ 1, а с уменьшением концентрации α все больше стремится к 1.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
Отношение активности (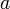 ) к общей концентрации вещества в растворе называется коэффициентом активности:
) к общей концентрации вещества в растворе называется коэффициентом активности:

Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
 ,
,
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов
Вопрос 42.
Химические реакции в растворах электролитов протекают, как правило, с высокими скоростями, и химическое равновесие большинства процессов устанавливается быстро.
Химические свойства раствора электролита складываются изсвойств образующих его ионов. Группа электролитов, содержащаяодин и тот же вид ионов, обладает сходными химическими свойствами. Так, все растворы, содержащие хлорид-ионы, при добавлениик ним раствора нитрата серебра дают белый осадок хлоридасеребраAgCl. Подобные качественные реакции на данный вид ионовшироко используются в аналитической химии при определении состава растворов.
Основным фактором, влияющим на смещение равновесия в растворах электролитов, является изменение концентрации ионов. Поэтому обменные реакции в растворах идут в сторону малорастворимых веществ или слабых электролитов. Это правило легко объяснимо, так как в результате протекания таких процессов один или несколько видов ионов выводятся из сферы взаимодействия, что в соответствии с принципом Ле-Шателье должно привести к более полному протеканию реакции. Малорастворимые вещества могут выводится из раствора или в виде осадка, или в виде газа. Слабыми электролитами могут быть кислоты и основания, вода и комплексы.
Произведение растворимости – величина, количественно характеризующая способность электролита растворяться.
Каждое условно нерастворимое вещество в некоторой степени все же растворяется, образуя при этом насыщенный раствор. Процесс диссоциации: Ag=Ag++Cl- Пр=[ Ag+]+[ Cl-]
В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре.
Вопрос 43.
Гидролиз – процесс взаимодействия соли с водой с образованием слабого электролита.
Гидролизу будут подвергаться соли, образованные:
1. сильным основанием и слабой кислотой.
2. слабым основанием и сильной кислотой.
3. слабым основанием и слабой кислотой.
Соли, образованные сильным основанием и слабой кислотой(Na2СO3, Na2S,) гидролизуются по аниону и раствор имеет щелочную реакцию среды:
\Na2CO32-+H2O=NaHCO3+NaOH
Соли, образованные слабым основанием и сильной кислотой(ZnCl2,Al2(SO4)3) гидролизуются по катиону и раствор имеет кислую реакцию среды:
ZnCl2+H2O=ZnOHCl+HCl
Соли, образованные слабым основанием и слабой кислотой ((NH4)2CO3, (NH4)2S) гидролизуются как по катиону, так и по аниону: (NH4)2CO3+2H2O=H2CO3+2NH4OH
Гидролиз возрастает с разбавлением раствора и пи увеличении температуры. Для подавления гидролиза следует ввести в раствор соли соответствующие кислоту или щелочь, являющиеся продуктами гидролиза.
Степень гидролиза показывает, какая часть от общего количества растворенной в воде соли подверглась гидролизу. Степень гидролиза очень часто выражают в процентах:
 .
.
Константа гидролиза – величина, равная произведению констант всех стадий, из которых складывается процесс гидролиза с учетом стехиометрических коэффициентов. Например:
NH4Cl → NH4+ + Cl-;
H2O  H+ + OH-; K1 = Kw = 10-14;
H+ + OH-; K1 = Kw = 10-14;
NH4+ + OH-  NH4OH; K2 = 1/K(NH4OH) = 1/1,7·10-5
NH4OH; K2 = 1/K(NH4OH) = 1/1,7·10-5
NH4+ + H2O  NH4OH + H+; Kобщ = K1·K2=5,7·10-10.
NH4OH + H+; Kобщ = K1·K2=5,7·10-10.
Чем выше величина константы, тем сильнее соль подвергается гидролизу.
 2018-01-21
2018-01-21 803
803








