Неполярная ковалентная связь – связь между атомами с равной электроотрицательностью (и, следовательно, равномерным распределением электронной плотности между ядрами атомов
C-C; F-F; Cl-Cl; O=O; N≡N
Если ковалентная связь образуется между двумя одинаковыми атомами, она называется неполярной
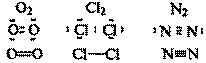
Неполярными являются также связи между одинаковыми атомными группировками.
Например, связь C—C в молекуле H3C—CH3.
Полярная ковалентная связь – связь между атомами с различной электроотрицательностью (2 > Δχ > 0,5) и несимметричным распределением общей электронной пары.
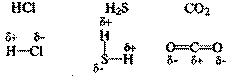
Электронная плотность такой связи смещена в сторону более электроотрицательного атома.
Направление смещения электронов обозначается также стрелкой:
C→ Cl; C→ O; C→N;
Ионная связь— это электростатическое взаимодействие между ионами с зарядами противоположного знака.
Ионная связь образуется между атомами с сильно отличающейся электроотрицательностью. При этом один атом отдает электроны и превращается в положительно заряженный ион, а атом, получивший электроны, в отрицательно заряженный. Ионы удерживаются вместе за счет сил электростатического притяжения.

Водородная связь образуется между полярными молекулами (вода, спирты,аммиак) за счет притяжения разноименных зарядов.
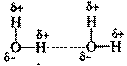
Прочность водородной связи существенно (~20 раз) меньше, чем ионной или ковалентной связи.
В периодической системе элементы распределяются по группам согласно количеству валентных электронов, а в периоды их относят по количеству энергетических уровней.Неорганические вещества:
 2018-01-21
2018-01-21 1071
1071







