Чтобы описать качественный состав вещества, перечисляют, атомы каких элементов входят в состав этого вещества.
При описании количественного состава молекулярного вещества указывают атомы каких элементов и в каком количестве образуют молекулу данного вещества.
При описании количественного состава немолекулярного вещества указывают отношение числа атомов каждого из элементов, входящих в состав этого вещества.
Моль любого вещества содержит одно и то же число частиц этого вещества (структурных единиц). Число структурных единиц, содержащихся в веществе количеством один моль равно 6,02·1023 и называется числом Авогадро (NА).

Вопрос №3. Стехиометрия. Важнейшие стехиометрические законы. Закон сохранения массы вещества, закон постоянства состава, закон простых объёмных отношений, закон Авогадро и следствия из этого закона. Относительная плотность газов.
СТЕХИОМЕТРИЯ раздел химии,изучающий количественные отношения между реагирующими веществами.
Формулировка закона сохранения массы: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
Закон постоянства состава: Всякое чистое вещество(молекулярной природы) независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Закон объемных отношений.
Объемы газов,вступивших в реакцию,относятся друг к другу,а также к объемам образующихся газообразных продуктов реакции, как небольшие целые числа.
Закон Авогадро.
В равных объемах различных газов и паров при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Следствие 1.
Моль одного газа при нормальных условиях занимает один и тот же объем,равный 22,4 л.Этот объем н-ся молярным объемом газа.
Следствие 2.
Отношение масс одинаковых объемов 2х разных газов н-ся относительной плотностью первого газа ко второму.
Д=М1/М2
Молярная масса газа равна его удвоенной относительной плотности по водороду.
Д=М1/М2
М(Н2)=2 г/моль
М1=2Д(2Н)
Вопрос №4 Эквивалент и молярная масса эквивалента (эквивалентная масса) простых и сложных веществ. Молярный объем эквивалента (эквивалентный объем). Закон эквивалентов.
Эквивалент -это реальная или условная частица в-ва, к-я может присоединять, замещать,
высвобождать или каким-либо др. образом быть равноценна одному иону водорода Н+ в ионообменных реакциях или одному электрону в о.в.р.
Эквивалент для элемента.
Э=1/В где: В-валентность элемента.
Э=fэкв f'экв=1/z
Для элемента: z –валентность
Для кислоты: z- основность
Для основания: z- кислотность
Для соли: z =n*b, где n- число атомов Ме,b – валентность.
Молярная масса эквивалента- это масса 1 моль эквивалентов в-ва. [г/моль]
Мэкв =М * fэкв
Закон эквивалентов
Массы реагирующих в-в, а также массы продуктов этой реакции, прямо пропорциональны молярным массам их эквивалентов
m1/m2=Mэкв1/Мэкв2
Молярный объем эквивалента- это объем одного моль эквивалентов газообразного в-ва при н.у.
Объемы реагирующих газообразных в-в, а также объемы газообразных продуктов реакции, прямо пропорциональны молярным объемам их эквивалентов.
V1/V2=Vмол(экв1)/Vмол(экв2)
Вопрос № 5 Ядерная модель атома. Атомные спектры. Энергетическое состояние электрона в атоме. Понятие о квантовых числах. Главное, орбитальное, магнитное и спиновое квантовые числа. Пределы их изменения. Нормальное и возбужденное состояние атома
Атомные спектры, оптические спектры, получающиеся при испускании или поглощении электромагнитного излучения свободными или слабо связанными атомами (например, в газах или парах). Являются линейчатыми, то есть состоят из отдельных спектральных линий, характеризуемых частотой излучения v, которая соответствует квантовому переходу между уровнями энергии Ei и Ek атома согласно соотношению: hv = Ei-Ek где h-постоянная Планка.
Атом – это наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
По современным представлениям атом - это электронейтральная частица, состоящая из положительно заряженного ядра и компенсирующих его заряд электронов.
В свою очередь ядро атома состоит из протонов, нейтронов (общее название - нуклоны) и большого числа других частиц. Электроны атома образуют его электронную оболочку, строение которой определяет многие химические свойства элемента.
Протон  - положительно заряженная микрочастица с зарядом +1,6·10-19 К, условно принятым за единицу положительного заряда qр = +1. Масса протона близка к 1 а.е.м. Общее число протонов Np, входящих в состав ядра, определяет общий заряд ядра атома и его порядковый номер в Периодической системе элементов Д.И. Менделеева.
- положительно заряженная микрочастица с зарядом +1,6·10-19 К, условно принятым за единицу положительного заряда qр = +1. Масса протона близка к 1 а.е.м. Общее число протонов Np, входящих в состав ядра, определяет общий заряд ядра атома и его порядковый номер в Периодической системе элементов Д.И. Менделеева.
Нейтрон  - электронейтральная микрочастица входящая в состав ядра атома. Его масса, как и масса протона, близка к 1 а.е.м.
- электронейтральная микрочастица входящая в состав ядра атома. Его масса, как и масса протона, близка к 1 а.е.м.
Нуклоны (от лат. nucleus – ядро, зерно, косточка) – собирательное название протонов и нейтронов – основных частиц, образующих атомные ядра.
Электрон ē - отрицательно заряженная микрочастица, входящая в состав атома и несущая наименьший электрический заряд -1,6×10-19 Кл. Для удобства величина этого «элементарного» заряда принята за единицу qe = -1. Так как атом в целом электронейтрален, то число электронов равно заряду ядра этого атома.
Основная масса атома (m) сосредоточена в его ядре, так как масса электронов мала и не вносит существенного вклада в массу всего атома. Масса электрона составляет лишь 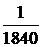 от массы протона или нейтрона.
от массы протона или нейтрона.
Масса атома складывается исходя из масс всех протонов (Np) и нейтронов (Nn) и характеризуется массовым числом (А).
Массовое число атома какого-либо элемента (А) численно равно сумме масс общего числа протонов (Np) и общего числа нейтронов (Nn):
A = Np + Nn.
 2018-01-21
2018-01-21 1538
1538
