∆G<0
- реакция возможна при дополнительных условиях(равновесие смещено в сторону образования продуктов реакции)
∆G>0
-реакция невозможна в данных условиях(равновесие смещено в сторону образ-я исх-х в-в)
(при ∆G > 300 кДж/моль,реакция невозможна в принципе)
∆G=0
-система находится в состоянии химического равновесия.
Вопрос №10. Химическая кинетика. Скорость химических реакций. Зависимость скорости реакций от концентрации реагирующих веществ и давления. Закон действующих масс. Константа скорости химической реакции. Во сколько раз увеличиться скорость реакции: N2+3H2-> 2NH3 при увеличении давления в 2 раза?
Химическая кинетика - раздел химии, изучающий скорости и механизмы химических процессов, а также их зависимость от различных факторов.
скорость реакции - это величина, показывающая изменение молярной концентрации одного из веществ в единицу времени.
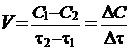 [моль/л·с].
[моль/л·с].
Скорость химической реакции зависит от целого ряда факторов:
• природы реагирующих веществ;
• концентрации реагирующих веществ;
• давления (для газовых систем);
• температуры системы;
• площади поверхности (для гетерогенных систем);
• наличия в системе катализатора и других факторов.
Закон действующих масс гласит: скорость элементарной химической реакции при постоянной температуре прямо пропорциональна произведению молярных концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам.
В общем случае, если в элементарную реакцию вступают одновременно т молекул вещества А и n молекул вещества В:
mА + nВ = С,
то уравнение для скорости реакции (кинетическое уравнение)
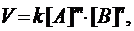
где k - коэффициент пропорциональности, который называется константой скорости химической реакции;
Константа скорости реакции k численно равна скорости реакции, в которой концентрации реагирующих веществ (или их произведение в кинетических уравнениях) равны единице.
Основной закон химической кинетики:
Скорость химич-ой р-ии прямо пропорциональна произведению концентрации реагирующих в-в в степенях их стехиометрических коэффициентов.
 2018-01-21
2018-01-21 563
563








