ОПРЕДЕЛЕНИЕ ТЕПЛОЕМКОСТИ ГАЗОВ
5.1. Цель работы
Получить понятие об удельной теплоемкости вещества или газа, какие виды теплоемкости бывают, от чего они зависят. Изучить экспериментальную методику определения теплоемкости воздуха.
5.2. Задачи работы
Методом простого калориметра определить среднюю теплоемкость воздуха для интервала температур.
Удельной теплоемкостью вещества называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1 ºС или 1 К.
Количество вещества может быть задано массой (кг), объемом (м3), молярной массой (кмоль), поэтому различают три вида теплоемкости:
1) Массовая С, Дж/(кг∙К)
2) Объемная С/, Дж/(м3∙К)
3) Мольная Сμ, Дж/(кмоль∙К)
Связь между массовой, объемной и мольной теплоемкостями представлена следующими формулами:


 (5.1)
(5.1)
Теплоемкость идеальных газов зависит от атомности, характера процесса и температуры.
Теплоемкость реальных газов, кроме перечисленных выше факторов, зависит еще и от давления.
Для практических расчетов зависимость теплоемкости от температуры достаточно точно будет определяться уравнением второй степени:
С = a + b∙t +e∙t2 (5.2)
Значения a, b и е (табличные данные) будут различны для разных видов теплоемкостей.

Рис. 5.1. Зависимость теплоемкости от температуры
График зависимости теплоемкости от температуры, определяемый уравнением второй степени представлен на рис. 5.1.
Различают также среднюю теплоемкость, которая в интервале температур от t1 до t2 равна:
 (5.3)
(5.3)
где q1-2 – количество теплоты, подведенное в процессе 1-2, кДж/кг;
t1 и t2 – температура в начале и в конце процесса 1-2 подвода теплоты, ºС.
Если выражение (5.3) записать для бесконечно малого количества теплоты dq и интервала температур dt, то получим формулу так называемой истинной теплоемкости С при данной температуре t:
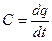 (5.4)
(5.4)
Подведенное количество теплоты для уравнения второй степени определяется по формуле:
 , Дж/кг (5.5)
, Дж/кг (5.5)
На рис. 5.1 количество теплоты q1-2 изображается площадью 1/-1-2-2/-1/.
Это же количество теплоты можно выразить через среднюю теплоемкость:
 , Дж/кг (5.6)
, Дж/кг (5.6)
В данном случае на рис. 5.1 количество теплоты q1-2 изображается площадью 1/-1//-2//-2/-1/
Применение выражения (5.6) удобно при наличии таблиц средних теплоемкостей  m в интервале температур от 0 до t.
m в интервале температур от 0 до t.
В теплотехнике особое значение имеют два случая нагревания (охлаждения): при постоянном давлении (изобарный процесс) и при постоянном объеме (изохорный процесс). Обоим этим случаям соответствуют изобарные и изохорные теплоемкости, имеющие в обозначениях индексы «р» и «V».
При p = const: изобарная массовая (СР), изобарная объемная (СР/) и изобарная мольная (СРμ) теплоемкости.
При v = const: изохорная массовая (СV), изохорная объемная (СV/) и изохорная мольная (СVμ) теплоемкости.
Изобарная теплоемкость всегда больше изохорной:
СР> СV СР/> СV/ СРμ>СVμ
Для идеальных газов связь между изобарной и изохорной теплоемкостями устанавливается уравнениями Майера:
СР – СV = R, кДж/(кг∙К)(5.7)
СРμ – СVμ = Rμ = 8314 кДж/(кг∙К) (5.8)
В технической термодинамике большое значение имеет отношение теплоемкостей при постоянном давлении и постоянном объеме, называемое показателем адиабаты k:
 (5.9)
(5.9)
Теплоемкости газовых смесей определяют по формулам:
ССМ = Σ(Сi·gi) (5.10)
С/СМ = Σ(С/i·ri) (5.11)
Сμ СМ = Σ(Сμi·ri) (5.12)
где gi и ri – соответственно массовая и объемная доля i-гo компонента газовой смеси;
Сi, С/i, Сμi – соответственно массовая, объемная и киломольная теплоемкость i-гo компонента;
Ссм, С/см, СμСМ – соответственно массовая, объемная и киломольная теплоемкость газовой смеси;
5.4. Описание лабораторной установки
Принципиальная схема электрокалориметра приведена на рис. 5.1. Установка состоит из простого калориметра 2, внутри которого помещена нихромовая спираль 3, служащая для подогрева проходящего воздуха. Для снижения тепловых потерь в охлаждающую среду калориметр окружен оболочкой 5.

Рис. 5.1. Схема электрокалориметра:
1 – термопара; 2 – трубка калориметра; 3 – электроспираль;
4 – потенциометр; 5 – оболочка калориметра; 6 – мерное сопло;
7 – вакуумметр; 8 – лабораторный автотрансформатор; 9 – вольтметр;
10 – амперметр; 11 – вакуумный насос; 12 – выходной ресивер
На оси калориметра укреплена дифференциальная хромель-алюмелевая термопара 1, с помощью которой производится замер разности температур воздуха ΔtВ на входе и выходе калориметра (холодные спаи расположены на входе, горячие на выходе). Вакуумный насос 12 создает разрежение, под действием которого атмосферный воздух проходит через калориметр. Количество проходящего воздуха пропорционально перепаду давления, измеряемого вакуумметром 8, перепад давления создается мерным соплом 7, установленным на входе во входной ресивер 6.
В установке, кроме перечисленных приборов, используются амперметр 11 и вольтметр 10 переменного тока, лабораторный автотрансформатор 9, барометр, термометр для измерения температуры атмосферного воздуха, потенциометр 4 для измерения термо-ЭДС термопары.
5.5. Порядок выполнения работы
1) Перед включением вакуумного насоса необходимо замерить диаметр мерного сопла.
2) Включить вакуумный насос, потенциометр и автотрансформатором установить мощность спирали нагревателя для первой серии опыта в пределах 10...15 Вт.
3) Через калориметр пропускается воздух до тех пор, пока не стабилизируются показания потенциометра.
4) После стабилизации параметров потока воздуха снимают показания вакуумметра Δ р, температуры t0 и давления р0 окружающего воздуха, значения тока I, напряжения U и показания разности температур Δ tВ по потенциометру.
5) Замеры делают не менее трех раз через 1...2 мин.
6) Результаты показаний приборов записывают в таблицу 5.1.
Таблица 5.1
| № опыта | Параметры нагревателя | Δ p, Па | p0, Па | t0, ºC | Δ tВ, ºC | |
| I, А | V, В | |||||
5.6. Обработка результатов измерений
1) Определить количество теплоты, подведенной к воздушному потоку в единицу времени:
Q = I · U, Вт или Дж/с (5.13)
2) Действительный расход воздуха определяют по формуле:
 , кг/с (5.14)
, кг/с (5.14)
где ρВ – плотность воздуха перед калориметром в ресивере, кг/м3;
SС – сечение сопла, м2;
µ = 0,96 – коэффициент расхода воздуха.
3) Плотность воздуха рассчитывается из уравнения состояния, которое выглядит следующим образом:
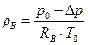 , кг/м3 (5.15)
, кг/м3 (5.15)
где RB = 287,08 Дж/кг·К – индивидуальная газовая постоянная воздуха (см. приложение 2);
Т0 – температура окружающего воздуха, К.
4) Определить среднюю удельную изобарную теплоемкость воздуха для интервала температур t0 – t:
 , кДж/кг·К (5.16)
, кДж/кг·К (5.16)
5) Считая воздух идеальным газом и воспользовавшись уравнением Майера, найти среднюю удельную изохорную теплоемкость воздуха:
 , кДж/кг·К (5.17)
, кДж/кг·К (5.17)
6) Результаты расчетов сводят в таблицу 5.2.
Таблица 5.2
Результаты расчетов
| № опыта | Q, Дж/с | ρВ, кг/м3 | mB, кг/с | сР, Дж/кг·К | сV, Дж/кг·К |
5.7. Оформление отчета
Отчет по работе должен включать цель работы, задачи работы, схему и описание лабораторной установки, таблицы измерений и результатов вычислений.
5.8. Контрольные вопросы
1) Что называют удельной теплоемкостью вещества или газа, от чего она зависит?
2) Что такое истинная теплоемкость вещества или газа?
3) Как определяется средняя теплоемкость для данного интервала температур?
4) Чем выражается количество теплоты на графике зависимости теплоемкости от температуры?
5) Как выражается связь между изобарной и изохорной теплоемкостями?
 2017-10-25
2017-10-25 1387
1387








