ИЗУЧЕНИЕ ТЕРМОДИНАМИЧЕСКИХ ПРОЦЕССОВ ИЗМЕНЕНИЯ СОСТОЯНИЯ ИДЕАЛЬНЫХ ГАЗОВ
7.1. Цель работы
Изучить основные термодинамические процессы изменения состояния идеального газа и порядок определения термодинамических параметров, характеризующие тот или иной процесс.
7.2. Задачи работы
Определить параметры идеального газа при изменении его состояния в заданном термодинамическом процессе.
К основным термодинамическим процессам относят следующие четыре процесса:
· изохорный – при постоянном объеме (v = const);
· изобарный – при постоянном давлении (р = const);
· изотермический – при постоянной температуре (Т = const);
· адиабатный – без теплообмена с внешней средой (Δ q = 0).
На рисунках 7.1 – 7.4 показаны графические изображения основных термодинамических процессов изменения состояния идеальных газов в р-v и Т-s координатах.
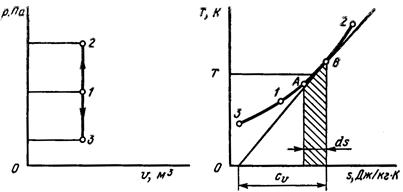
Рис. 7.1. Графическое изображение изохорного процесса

Рис. 7.2. Графическое изображение изобарного процесса

Рис. 7.3. Графическое изображение изотермического процесса

Рис. 7.4. Графическое изображение адиабатного процесса
В реальных условиях указанные ограничения практически не выполняются. В связи с этим в технической термодинамике существует понятие политропного процесса как общего случая термодинамического процесса. Предполагается, что политропный процесс обратим и теплоемкость рабочего тела (идеального газа) СП в ходе данного процесса не изменяется.
В таблицах 7.1. и 7.2 представлены формулы для расчета характеристик основных термодинамических процессов изменения состояния идеальных газов. При составлении этой таблицы было принято, что количество рабочего тела равно 1 кг, теплоемкость газа постоянна и четыре основных термодинамических процесса являются частными случаями политропного процесса при соответствующих значениях «n».
Таблица 7.1
Характеристики изохорного, изобарного и изотермического процессов идеального газа
| Характеристика процесса | Название процесса | ||
| Изохорный | Изобарный | Изотермический | |
| Показатель политропы «n» | n = ∞ | n = 0 | n = 1 |
| Уравнение процесса | v = const;  | р = const;  | T = const; p∙v = const |
| Теплоемкость, кДж/(кг∙К) | CV | СР = CV + R | ∞ |
| Изменение внутренней энергии Δ u1-2 = u2 - ul, кДж/кг | Δ u1-2 = CV (T2 – T1) | Δ u1-2 = CV (T2 – T1) | |
| Изменение энтальпии Δ h1-2 = h2 - hl, кДж/кг | Δ h1-2 = СР (Т2 – T1) | Δ h1-2 = СР (Т2 – T1) | |
| Изменение энтропии Δ s1-2 = s2 - sl, кДж/кг |  |  |  |
Продолжение табл. 7.1
| Характеристика процесса | Название процесса | ||
| Изохорный | Изобарный | Изотермический | |
| Количество теплоты q1-2, кДж/кг | q1-2 = Δ u1-2 = = СV (T2 – T1) | q1-2 = СР (T2 – T1) |  |
| Работа изменения объема l1-2, кДж/кг | l1-2 = P·(v2 – v1) = = R·(T2 – T1) |  | |
| Работа техническая l/1-2, кДж/кг | l/1-2 = – v(P2 – P1) = = – R(T2 – T1) |  |
Таблица 7.2
Характеристики адиабатного и политропного процессов идеального газа
| Характеристика процесса | Наименование процесса | |
| Адиабатный | Политропный | |
| Показатель политропы «n» |  >1 >1 | 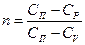 |
| Уравнение процесса | p∙vk = const | p∙vn = const |
| Теплоемкость, кДж/(кг∙К) |  | |
| Изменение внутренней энергии Δ u1-2 = u2 – ul, кДж/кг | Δ u1-2 = CV(T2 – T1) | Δ u1-2 = CV(T2 – T1) |
| Изменение энтальпии Δ h1-2 = h2 – hl, кДж/кг | Δ h1-2 = СР (Т2 – T1) | Δ h1-2 = СР (Т2 – T1) |
| Изменение энтропии Δ s1-2 = s2 – sl, кДж/кг |  |
Продолжение табл. 7.2
| Характеристика процесса | Наименование процесса | |
| Адиабатный | Политропный | |
| Количество теплоты q1-2, кДж/кг |  | |
| Работа изменения объема l1-2, кДж/кг |  |  |
| Работа техническая l/1-2, кДж/кг |  | 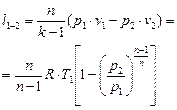 |
7.4. Порядок выполнения работы
1) Получить у преподавателя исходные данные: название газа, тип термодинамического процесса, начальные и конечные значения параметров газа, значение показателя процесса.
2) Определить начальный объем заданного газа по формуле:
 , м3/кг (7.1)
, м3/кг (7.1)
где Т1 = t1 + 273, K;
R – индивидуальная газовая постоянная заданного газа (см. приложение 2)
3) Определить конечные параметры заданного газа, используя следующие уравнения:
а) Изохорный процесс:
v 1 = v 2 и  (7.2)
(7.2)
б) Изобарный процесс:
р 1 = р 2 и  (7.3)
(7.3)
Т 1 = Т 2 и p1∙v1 = p2∙v2 (7.4)
г) Адиабатный процесс:


 (7.5)
(7.5)


 (7.6)
(7.6)
4) Используя формулы в таблице 7.2 определить характеристики заданного процесса:
а) Теплоемкость газа (теплоемкости СV и СР выбирают по приложению 3 при средней температуре)
б) Изменение внутренней энергии Δ u1-2.
в) Изменение энтальпии Δ h1-2.
г) Изменение энтропии Δ s1-2.
д) Количество теплоты q1-2.
е) Работу изменения объема l1-2
7.5. Оформление отчета
Отчет по работе должен включать цель работы, задачи работы, результаты вычислений.
7.6. Контрольные вопросы
1. Рассказать условия протекания основных термодинамических процессов.
2. Привести уравнения состояния основных термодинамических процессов.
3. Нарисовать и объяснить график конкретного термодинамического процесса, указанного преподавателем.
4. Как определяется количество теплоты в конкретном термодинамическом процессе (по указанию преподавателя)?
 2017-10-25
2017-10-25 2143
2143








