Теплоемкость – это количество теплоты, которое необходимо сообщить системе для увеличения ее температуры на 1 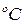 (К) при отсутствии полезной работы и постоянстве соответствующих параметров.
(К) при отсутствии полезной работы и постоянстве соответствующих параметров.
Если в качестве системы мы берем индивидуальное вещество, то общая теплоемкость системы 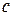 равняется теплоемкости 1 моль вещества (
равняется теплоемкости 1 моль вещества (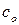 ) умноженное на число моль (
) умноженное на число моль (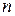 ).
).
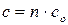 . (16)
. (16)
Теплоемкость может быть удельная и молярная.
Удельная теплоемкость 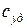 – это количество теплоты, необходимое для нагревания единицы массы вещества на 1 град (интенсивная величина).
– это количество теплоты, необходимое для нагревания единицы массы вещества на 1 град (интенсивная величина).
Молярная теплоемкость 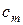 – это количество теплоты, необходимое для нагревания одного моль вещества на 1 град.
– это количество теплоты, необходимое для нагревания одного моль вещества на 1 град.
Различают истинную и среднюю теплоемкость.
В технике обычно используют понятие средней теплоемкости.
Средняя 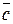 – это теплоемкость для определенного интервала температур.
– это теплоемкость для определенного интервала температур.
Если системе, содержащей количество вещества 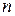 или массой
или массой 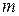 , сообщили количество теплоты
, сообщили количество теплоты 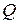 , а температура системы повысилась от
, а температура системы повысилась от 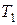 до
до 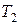 , то можно рассчитать среднюю удельную или молярную теплоемкость:
, то можно рассчитать среднюю удельную или молярную теплоемкость:
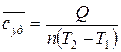 ,
, 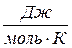 . (17)
. (17)
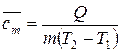 ,
, 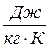 . (18)
. (18)
Истинная молярная теплоемкость 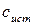 – это отношение бесконечно малого количества теплоты, сообщенной 1 моль вещества при определенной температуре, к приращению температуры, которое при этом наблюдается.
– это отношение бесконечно малого количества теплоты, сообщенной 1 моль вещества при определенной температуре, к приращению температуры, которое при этом наблюдается.
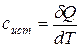 . (19)
. (19)
Согласно уравнению (19), теплоемкость, как и теплота, не является функцией состояния. При постоянном давлении или объеме, согласно уравнениям (11) и (12), теплота, а, следовательно, и теплоемкость приобретают свойства функции состояния, то есть становятся характеристическими функциями системы. Таким образом, получаем изохорную и изобарную теплоемкости.
Изохорная теплоемкость 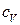 – количество теплоты, которое необходимо сообщить системе, чтобы повысить температуру на 1
– количество теплоты, которое необходимо сообщить системе, чтобы повысить температуру на 1 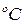 , если процесс происходит при
, если процесс происходит при 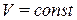 .
.
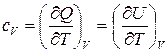 . (20)
. (20)
Изобарная теплоемкость 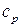 – количество теплоты, которое необходимо сообщить системе, чтобы повысить температуру на 1
– количество теплоты, которое необходимо сообщить системе, чтобы повысить температуру на 1 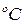 при
при 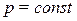 .
.
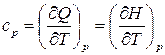 . (21)
. (21)
Теплоемкость зависит не только от температуры, но и от объема системы, поскольку между частицами существуют силы взаимодействия, которые изменяются при изменении расстояния между ними, поэтому в уравнениях (20) и (21) используют частные производные.
Энтальпия идеального газа, как и его внутренняя энергия, является функцией только температуры:
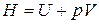 ,
,
а в соответствии с уравнением Менделеева–Клапейрона 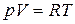 , тогда
, тогда
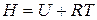 . (22)
. (22)
Поэтому для идеального газа в уравнениях (20), (21) частные производные можно заменить на полные дифференциалы:
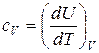 . (23)
. (23)
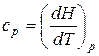 . (24)
. (24)
Из совместного решения уравнений (23) и (24) с учетом (22), получим уравнение взаимосвязи между 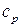 и
и 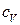 для идеального газа.
для идеального газа.
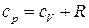 . (25)
. (25)
Разделив переменные в уравнениях (23) и (24), можно рассчитать изменение внутренней энергии и энтальпии при нагревании 1 моль идеального газа от температуры 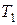 до
до 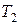
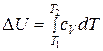 . (26)
. (26)
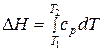 . (27)
. (27)
Если в указанном интервале температур теплоемкость можно считать постоянной, то в результате интегрирования получаем:
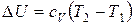 . (28)
. (28)
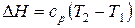 . (29)
. (29)
Установим взаимосвязь между средней и истинной теплоемкостью. Изменение энтропии с одной стороны выражается уравнением (27), с другой –
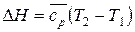 .
.
Приравняв правые части уравнений и выразив среднюю теплоемкость, имеем:
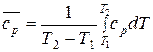 . (30)
. (30)
Аналогичное выражение можно получить для средней изохорной теплоемкости.
Теплоемкость большинства твердых, жидких и газообразных веществ повышается с ростом температуры. Зависимость теплоемкости твердых, жидких и газообразных веществ от температуры выражается эмпирическим уравнением вида:
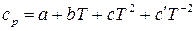 . (31)
. (31)
где а, b, c и 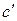 – эмпирические коэффициенты, вычисленные на основе экспериментальных данных о
– эмпирические коэффициенты, вычисленные на основе экспериментальных данных о 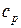 , причем коэффициент
, причем коэффициент 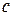 относится к органическим веществам, а
относится к органическим веществам, а 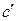 – к неорганическим. Значения коэффициентов для различных веществ приведены в справочнике и применимы только для указанного интервала температур.
– к неорганическим. Значения коэффициентов для различных веществ приведены в справочнике и применимы только для указанного интервала температур.
Теплоемкость идеального газа не зависит от температуры. Согласно молекулярно-кинетической теории теплоемкость, приходящаяся на одну степень свободы, равна 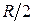 (степень свободы – число независимых видов движения на которые можно разложить сложное движение молекулы). Для одноатомной молекулы характерно поступательное движение, которое можно разложить на три составляющие в соответствии с тремя взаимно перпендикулярными направлениями по трем осям. Поэтому изохорная теплоемкость одноатомного идеального газа равна
(степень свободы – число независимых видов движения на которые можно разложить сложное движение молекулы). Для одноатомной молекулы характерно поступательное движение, которое можно разложить на три составляющие в соответствии с тремя взаимно перпендикулярными направлениями по трем осям. Поэтому изохорная теплоемкость одноатомного идеального газа равна
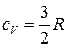 . (32)
. (32)
Тогда изобарная теплоемкость одноатомного идеального газа согласно (25) определится по уравнению
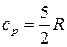 . (33)
. (33)
Двухатомные молекулы идеального газа помимо трех степеней свободы поступательного движения имеют и 2 степени свободы вращательного движения. Следовательно:
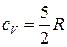 ,
, 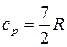 .
.
 2014-02-12
2014-02-12 16770
16770
