Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения. (совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов в молекулу)
Появление атомной модели Бора, впервые объяснившей строение электронной оболочки, способствовало созданию представления о химической связи и её электронной природе. В соответствии с моделью Бора электроны могут занимать в атоме положения, которым отвечают определенные энергетические состояния, т. е. энергетические уровни. В 1915г. немецкий физик Коссель дал объяснение химической связи в солях, а в 1916 году американский учёный Льюис предложил трактовку химической связи в молекулах. Они исходили из представлений о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов (полного заполнения внешнего электронного слоя). Представления Косселя и Льюиса получили названия электронной теории валентности.
Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней.
Различают три основных типа химической связи: ковалентную(полярная, неполярная)
 ,
,  ., ионную NaCl, металлическую Na, Ba, Al,
., ионную NaCl, металлическую Na, Ba, Al, .
Таблица.Типы химической связи и их основные отличительные признаки.
| Химическая связь | Связываемые атомы | Характер элементов | Процесс в электронной оболочке | Образующиеся частицы | Кристаллическая решетка | Характер вещества | Примеры |
| Ионная | Атом металла и атом неметалла | Электроположительный и электро отрицательный | Переход валентных электронов | Положительные и отрицательные ионы | Ионная | Солеобразный | NaCl CaO NaOH |
| Ковалентная | Атомы неметаллов (реже-атомы металлов) | Электроотрицательный реже электроположительный | Образование общих электронных пар, заполнение молекулярных орбиталей | Молекулы | Молекулярная | Летучий или нелетучий | Br2 CO2C6H6 |
| --------- | Атомная | Алмазоподоб ный | Алмаз Si SiC | ||||
| Металличес кая | Атомы металлов | Электроположительный | Отдача валентных электронов | Положительные ионы и электронный газ | Металлическая | Металлическая | Металлы и сплавы |
Метода описания химических связей:
1. Метод молекуярных орбиталей Ψ = С1ψ1+ С2ψ2+ … + Сnψn
Образование химической связи является результатом перехода электронов с атомных орбиталей на новые энергетические уровни (молекулярные орбитали), обладающие энергией, определяемые всеми атомами в молекуле.
1.После перехода электрона с атомных орбиталей на молекулярные, атомные орбитали теряют свою индивидуальность..
2Каждой молекулярной орбитали соответствует своя энергия.
3Молекулярные орбитали не локализованы в межъядерном пространстве двух атомов. Они в ряде случаев могут перемещаться в поле действия всех ядер молекул.
4Заполнение молекулярных орбиталей происходит в соответствии с правилом Хунда и принципом Паули.
5Если переход электронов с атомных орбиталей на молекулярные энергетически не выгодно, то химическая связь не образуется.
6Образование химических связей всегда сопровождается уменьшением общей энергии системы.
2. Метод резонансных структур. 1) Резонансные структуры не должны отличатьсярасположением атомов.2) Каждая резонансная структура не должна изменять валентность атомов. 3) Все резонансные структуры должны иметь одинаковое число неспаренных электронов.
6. Понятие энтальпии. Энтальпия реакции. Энтальпия образования химических соединений.
Энтальпия системы (от греч. enthalpo нагреваю) – это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением
H = U + PV, где V – объем системы.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:  , ΔH = ΔU + PΔV
, ΔH = ΔU + PΔV
Тепловой эффект реакции (энтальпия реакции), теплота, выделенная или поглощенная термодинамической системой при протекании в ней химической реакции. Определяется при условии, что система не совершает никакой работы (кроме возможной работы расширения), а температуры реагентов и продуктов равны. Поскольку теплота не является функцией состояния, т.е. при переходе между состояниями зависит от пути перехода, то в общем случае тепловой эффект реакции не может служить характеристикой конкретной реакции. В двух случаях бесконечно малое количество теплоты (элементарная теплота) dQ совпадает с полным дифференциалом функции состояния: при постоянстве объема dQ = = dU (U-внутренняя энергия системы), а при постоянстве давления dQ = dH (H-энтальпия системы).
Практически важны два типа теплового эффекта реакции - изотермо-изобарный (при постоянных температуре Т и давлении р) и изотермо-изохорный (при постоянных Т и объеме V). Различают дифференциальный и интегральный тепловой эффект реакции Дифференциальный тепловой эффект реакции определяется выражениями:

нтальпия образования (теплота образования), энтальпия реакции образования данного вещества (или раствора) из заданных исходных веществ. Энтальпией образования химических соединения называют энтальпию реакции образования данного соединения из простых веществ. В качестве простых веществ выбирают химические элементы в их естественном фазовом и химическом состоянии при данной температуре. Так, при 298 К для хлора простым веществом служит газообразный хлор, состоящий из молекул С12, а для калия - металлический калий. Энтальпия образования твердого КСl при 298 К - это энтальпия реакции:
К(тв.) + 1/2Сl2= КСl(тв.).
Энтальпия образования КСl (тв.) при 500 К соответствует реакции: К(жидкий) + 1/2Cl2 = КСl(тв.), так как естественным фазовым состоянием (простым веществом) для калия становится уже не кристалл, а жидкость (т-ра плавления К 336,66 К).
Энтальпия образования может быть определена при любой температуре. Стандартные энтальпии образования 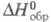 соответствуют реакциям образования, при которых и простые вещества, и получающееся соединение находятся придавлении 1 атм (1,01 x 105 Па). По определению, для всех простых веществ при любой температуре
соответствуют реакциям образования, при которых и простые вещества, и получающееся соединение находятся придавлении 1 атм (1,01 x 105 Па). По определению, для всех простых веществ при любой температуре  = 0. Для большинства хим. соед. энтальпия образования- отрицат. величины.
= 0. Для большинства хим. соед. энтальпия образования- отрицат. величины.
Единицы измерения энтальпии образования - Дж/г, Дж/моль.
В термодинамике растворов (расплавов) под энтальпией образования понимают изменение энтальпии при изотермо-изобарном образовании 1 моля (1 г) раствора (расплава) данного состава из чистых компонентов. Так, в двухкомпонентной системе KF-A1F3 энтальпия образования расплава 50 %-ного молярного состава соответствует процессу: 1/2КF(жидкий) + 1/2А1F3(жидкий) = КF-А1F3(расплав, 50 мол. %).
Законы термохимии. Определение средней энергии связи.
Первый закон термохимии (Лавуазье и Лаплас, 1780—1784):
тепловой эффект образования данного соединения в точности равен, но обратен по знаку тепловому эффекту его разложения.
Из закона Лавуазье—Лапласа следует невозможность построить вечный двигатель I рода, использующий энергию химических реакций.
Второй закон термохимии (Г. И. Гесс, 1840):
тепловой эффект химической реакции не зависит от характера и последовательности отдельных ее стадий и определяется только начальными и конечными продуктами реакции и их физическим состоянием (при p=const или при v=const).
7)
Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами, измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Стандартной теплотой (энтальпией) образования называется тепловой эффект (изменение стандартной энтальпии) реакции образования одного моля этого вещества из простых веществ в стандартном состоянии. Стандартная энтальпия образования простых веществ в этом случае принята равной нулю.
В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов, а тепловой эффект реакции (ΔН) записывать отдельно, через запятую. Например, термохимическое уравнение
4NH3(г) + 3O2(г) → 2N2(г) + 6H2O(ж), ΔН=-1531 кДж
показывает, что данная химическая реакция сопровождается выделением 1531 кДж теплоты, при давлении 101 кПа, и относится к тому числу молей каждого из веществ, которое соответствует стехиометрическому коэффициенту в уравнении реакции.
В термохимии также используют уравнения, в которых тепловой эффект относят к одному молю образовавшегося вещества, применяя в случае необходимости дробные коэффициенты.
Закон Гесса
В основе термохимических расчётов лежит закон Гесса: Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
:
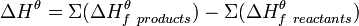 .
.
С помощью закона Гесса можно рассчитать энтальпии образования веществ и тепловые эффекты реакций, которые невозможно измерить экспериментально.
Закон Кирхгофа
Закон Кирхгофа устанавливает зависимость теплового эффекта химической реакции от температуры: температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции. Закон Кирхгофа лежит в основе расчёта тепловых эффектов при разных температурах.
Для многоатомных молекул с одним типом связи, например, для молекул АВn, средняя энергия связи равна 1/n части полной энергии образования соединения из атомов. Так, энергия образования СН4 = -1661,1 кДж/моль. Так как в молекуле СН4 четыре связи, то энергия одной связи С – Н равна 415,3 кДж/моль.
Если в молекуле соединяются более двух различных атомов, то средняя энергия связи не совпадает с величиной энергии диссоциации молекулы. Если в молекуле представлены различные типы связи, то каждому из них можно приближенно приписать определенное значение Е. Это позволяет оценить энергию образования молекулы из атомов. Например, энергию образования молекулы пентана из атомов углерода и водорода можно вычислить по уравнению:
Е = 4EC-C + 12EC-H.
8) Понятие энтропии. Стандартные значения энтропии, изменение энтропии в химической реакции.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается Δ S > 0
Стандартные энтропии простых веществ не равны нулю. В отличие от других термодинамических функций энтропия идеально кристаллического тела при абсолютном нуле равна нулю (постулат Планка), поскольку W = 1.
Энтропия зависит от:
- Агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар).
- Изотопного состава (H 2O и D 2O).
- Молекулярной массы однотипных соединений (CH 4, C 2H 6, н-C 4H 10).
- Строения молекулы (н-C 4H 10, изо-C 4H 10).
- Кристаллической структуры (аллотропии) – алмаз, графит.

Зависимость энтропии от температуры для свинца: Δ S пл = 8 Дж·моль –1·К –1; T пл = 600,5 К; Δ S кип = 88 Дж·моль –1·К –1; T кип = 2013 К.
Следовательно, стремление системы к беспорядку проявляется тем больше, чем выше температура.
 2018-01-21
2018-01-21 1539
1539
