3. Строение атома по модели Бора. Постулаты:
1. Электрон, находясь на круговой орбите, не поглащает и не излучает, а следовательно, он може оставаться на орбите сколь угодно долго.
Орбита, ближняя к ядру является более устойчивой. Состояние электрона на такой орбите называется основным.
2. Поглощение или выделение энергии происходит, когда электрон переходит с одной орбиты на другую.
Н. Бор в 1913 году предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца. Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Электронные орбиты в модели Бора обозначаются целыми числами 1, 2, 3, … n, начиная от ближайшей к ядру. В дальнейшем мы будем называть такие орбиты уровнями. Для описания электронного строения атома водорода достаточно одних только уровней. Но в более сложных атомах, как выяснилось, уровни состоят из близких по энергии подуровней. Например, 2-й уровень состоит из двух подуровней (2s и 2p). Третий уровень состоит из 3-х подуровней (3s, 3p и 3d) и т.д. В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме заселяют ближайшие к ядру уровни и подуровни, потому что в этом случае их энергия меньше, чем если бы они заселяли более удаленные уровни. На каждом уровне и подуровне может помещаться только определенное количество электронов. В каждой "комнате"-орбитали могут "жить" один или два электрона. Запрещение электронам находиться более чем по двое на одной орбитали называют запретом Паули - по имени ученого, который выяснил эту важную особенность строения атома. Каждый электрон в атоме имеет свой "адрес", который записывается набором четырех чисел, называемых "квантовыми".
Атомная орбиталь – область пространства в которой вероятность обнаружения электрона максимальна. Она может быть охарактеризована с помощью набора квантовых чисел, определяющих ее энергию, форму и пространственное расположение,
n – главное квантовое число
l - орбитальное квантовое число, l=0, s- орбиталь, l =1 p -орбиталь…
m¹- магнитное квантовое число
mˢ - спиновое квантовое число
4.Строение электронных оболочек атомов. Атомные орбитали. Квантовые числа.
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Каждая электронная оболочка может иметь определенное максимальное число электронов.
Электроны различаются своей энергией, чем дальше от ядра расположены электроны тем большим запасом энергии они обладают. Всегда в атоме имеются электроны С близкими значениями энергии, которые и образуют электронные слои в оболочке атома.
Число электронных слоёв равно номеру периода в периодической системе. Максимальное число электронов на слое можно найти с помощью формулы N=2n2,где N -число электронов на слое, n -номер слоя. Произведя простые рассчёты, выясним что на первом электронном слое будет 2 электрона, на втором-8, третьем-18, четвёртом-32. Но на внешнем электронном слое не может быть более 8 электронов, а для первого слоя не более 2. Это небходимо учитывать при распределении электронов по энергетическим слоям. Элементы подразделяются на s-, p-, d-, f-элементы. Какой подуровень заполняется последним, к такой группе и относится данный элемент. При заполнении ячеек электроны обозначаются стрелками (одна стрелка направлена вверх, другая вниз, это связано с тем, что электроны вращаются вокруг своей оси-один по часовой, другой-против часовой стрелки), причём в одной ячейке могут находиться не более двух электронов.
Порядок заполнения ячеек: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра.Данное количество вычисляется по формуле:
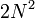
| S | p | d | f | g | Итого | |
| K | ||||||
| L | ||||||
| M | ||||||
| N | ||||||
| O |
.
Атомная орбиталь — одноэлектронная волновая функция в сферически симметричном электрическом поле атомного ядра, задающаяся главным n, орбитальным l и магнитным m квантовыми числами.
Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме; Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
Атомная орбиталь – область пространства в которой вероятность обнаружения электрона максимальна. Она может быть охарактеризована с помощью набора квантовых чисел, определяющих ее энергию, форму и пространственное расположение,
n – главное квантовое число
l - орбитальное квантовое число, l=0, s- орбиталь, l =1 p -орбиталь…
m¹- магнитное квантовое число
mˢ - спиновое квантовое число
Ква́нтовое число́ - численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы.
Некоторые квантовые числа связаны с движением в пространстве и характеризуют пространственное распределение волновой функции частицы. Это, например, радиальное (главное) (nr), орбитальное (l) и магнитное (m) квантовые числа электрона в атоме, которые определяются как число узлов радиальной волновой функции, значение орбитального углового момента и его проекция на заданную ось, соответственно.
 2018-01-21
2018-01-21 691
691







